题目内容
16. 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
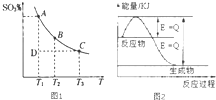
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态).
根据图1示回答下列问题:
①2SO2(g)+O2(g)?2SO3(g)的△H< (填“>”或“<”);
若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2;
反应进行到状态D时,V正>v逆(填“>”、“<”或“=)
(2)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g).
①该反应的平衡常数表达式为$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$.
已知K1000℃<K1200℃,则该反应是吸热反应(填“吸热”或“放热”).
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性S2-+H2O?HS-+OH-,所以水溶液呈碱性
(3)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①如图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式N2 (g)+3H2(g)═2NH3(g)△H=2(Q1-Q2) kJ•mol-1
(△H的数值用含字母Q1、Q2的代数式表示)
②氨气溶于水得到氨水.在25°C下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液中显中性,则:c(NH4+)= c(Cl-)(填“>”、“<”或“=”);
用含a和b的代数式表示该混合溶液中一水合出氨的电离平衡常数表达式$\frac{b×1{0}^{-7}}{a-b}$.
分析 (1)①由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,升高温度向吸热反应方向移动;
恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动;
②D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行;
(2)①依据平衡常数概念写出表达式,温度升高平衡常数增大,说明反应是吸热反应;
②硫化钠溶于水,硫离子水解显碱性,写出S2-水解方程式;
(3)①由图2求出N2和H2反应生成1molNH3的反应热,再根据热化学反应方程式的书写解答;
②将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液显中性,根据电荷守恒,溶液中c(OH-)=1×10-7mol/L,根据K=$\frac{c(N{H}_{4}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$计算.
解答 解:(1))①由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,即向左移动,升高温度向吸热反应方向移动,即该反应正反应为放热反应;恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动,即向左移动.
故答案为:<;向左;
②温度升高,平衡向吸热方向移动,即向逆反应移动,K值减小,K1>K2,D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行,所以V正>V逆,
故答案为:>;>;
(2)①Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),依据反应写出平衡常数K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$,已知K1000℃<K1200℃,温度升高平衡常数增大,则该反应是吸热反应,
故答案为:$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$;吸热;
②硫化钠溶于水溶液呈碱性,是因为硫离子水解的原因,反应的离子方程式为:S2-+H2O?HS-+OH-,故答为:S2-+H2O?HS-+OH-,所以水溶液呈碱性;
(3)①由图可知,N2和H2反应生成1molNH3放出的热量为(Q1-Q2)kJ,该反应的热化学反应方程式为N2(g)+3H2(g)?2NH3(g)△H=-2(Q1-Q2)kJ•mol-1,
故答案为:N2 (g)+3H2(g)═2NH3(g)△H=2(Q1-Q2) kJ•mol-1;
②溶液呈中性,c(H+)=c(OH-),电荷守恒得:c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以c(NH4+)=c(Cl-),将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,
溶液中c(NH4+)=c(Cl-)=$\frac{b}{2}$mol/L,混合后反应前c(NH3•H2O)=$\frac{a}{2}$mol/L,则反应后c(NH3•H2O)=($\frac{a}{2}$-$\frac{b}{2}$)mol/L,
则K=$\frac{c(N{H}_{4}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{\frac{b}{2}×1{0}^{-7}}{\frac{a}{2}-\frac{b}{2}}$=$\frac{b×1{0}^{-7}}{a-b}$,
故答案为:=;$\frac{b×1{0}^{-7}}{a-b}$.
点评 本题综合性较大,涉及平衡移动、电解质溶液有关计算、盐类水解和热化学方程式等,难度中等,是对学生综合能力的考查,有一定的难度.

 阅读快车系列答案
阅读快车系列答案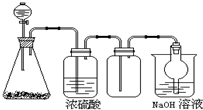 如图是一套实验室制气装置,用于发生、干燥、收集和吸收有毒气体.下列各组物质能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于发生、干燥、收集和吸收有毒气体.下列各组物质能利用这套装置进行实验的是( )| A. | MnO2和浓盐酸 | B. | Na2SO3(s)和浓H2SO4 | ||
| C. | 铁片和浓盐酸 | D. | 电石和水 |
①在浓硫酸存在下,能分别与CH3CH2OH或CH3COOH反应;
②在一定温度及浓硫酸存在下,能生成一种使溴水褪色的物质;
③在一定温度及浓硫酸存在下,能生成一种分式为C5H8O2的五元环状化合物.
则C5H10O3的结构简式为 ( )
| A. | HOCH2CH2COOCH2CH3 | B. | HOCH2CH2CH2CH2COOH | ||
| C. | CH3CH2CH(OH)CH2COOH | D. | CH3CH(OH)CH2CH2COOH |
| A. | 标准状况下,2.24L水含有0.1NA个水分子 | |
| B. | 0.3molSO2中含有的氧原子数为0.3NA | |
| C. | 标准状况下,22.4L氖气含有2NA个原子 | |
| D. | 1L 0.1mol/LMgCl2溶液中含Cl-数为0.2NA |
| A. | 纤维素$\stackrel{水解}{→}$葡萄糖$\stackrel{氧化}{→}$CO2和H2O(释放能量维持生命活动) | |
| B. | 淀粉$\stackrel{水解}{→}$葡萄糖$\stackrel{氧化}{→}$CO2和H2O(释放能量维持生命活动) | |
| C. | 蛋白质$\stackrel{水解}{→}$氨基酸$\stackrel{合成}{→}$人体所需的蛋白质(人体生长发育) | |
| D. | 油脂$\stackrel{水解}{→}$甘油和高级脂肪酸$\stackrel{氧化}{→}$CO2和H2O(释放能量维持生命活动) |
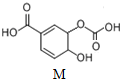
| A. | 分子式为C8H6O6 | |
| B. | 能发生中和、取代、消去、氧化、加成反应 | |
| C. | 1molM与溴水发生反应的产物可能有3种 | |
| D. | 1molM与足量氢氧化钠溶液反应,消耗4molNaOH |
| A. | 同系物的化学性质相似 | |
| B. | 甲烷、乙烷互为同系物 | |
| C. | 分子式相同,结构不同的化合物互称为同分异构体 | |
| D. | 同分异构体之间的转化属于物理变化 |
| A. | 1.8 g的NH4+中含有的电子数为0.1×6.02×1023 | |
| B. | 常温常压下,11.2 L氯气所含的原子数为6.02×1023 | |
| C. | 常温常压下,18 g H2O含有的原子数为3×6.02×1023 | |
| D. | 5.6 g金属铁变为离子时失去的电子数为0.2×6.02×1023 |