题目内容
如表是元素周期表的一部分,表中所列字母分别代表一种化学元素.请用元素符号等化学用语回答下列有关问题:
(1)上述元素中第一电离能最大的元素是 ,C、D、E、F四种元素第一电离能由大到小的顺序 .
(2)由A、C、D形成的ACD分子中,σ键个数:π键个数= .
(3)要证明太阳上是否含有R 元素,可采用的方法是 .
(4)能够说明K、F两元素非金属性强弱的事实是 ;若欲用一个简单实验证明H、I两种元素金属性的强弱,其实验方法是 .
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.已知MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是 (填“极性”或“非极性”)分子.
(6)C、D两种元素,C的气态氢化物难溶于水,而D的气态氢化物却极易溶于水,其原因是
(7)在元素N的低价硫酸盐溶液中,加入少量由元素G、L、E组成的化合物(原子个数比为1:1:1),观察到的现象是 ;有关反应的离子方程式为 .
| A | R | ||||||||||||||||
| C | D | E | F | ||||||||||||||
| B | H | I | J | K | L | ||||||||||||
| G | M | N | T | ||||||||||||||
(2)由A、C、D形成的ACD分子中,σ键个数:π键个数=
(3)要证明太阳上是否含有R 元素,可采用的方法是
(4)能够说明K、F两元素非金属性强弱的事实是
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.已知MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是
(6)C、D两种元素,C的气态氢化物难溶于水,而D的气态氢化物却极易溶于水,其原因是
(7)在元素N的低价硫酸盐溶液中,加入少量由元素G、L、E组成的化合物(原子个数比为1:1:1),观察到的现象是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知A为氢,B为Na,C为碳,D为氮,E为氧,F为氟,G为钾,H为Mg,I为Al,J为Si,K为硫,L为Cl,M为Cr,N为Fe,T为Cu,R为He.
(1)稀有气体的电离能最大;同周期随原子序数增大,元素第一电离能呈增大趋势,元素原子核外处于半满、全满时,能力较低,第一电离能高于同周期相邻元素;
(2)HCN结构式为H-C≡N,单键为σ键,三键含有1个σ键、2个π键;
(3)利用光谱分析确定是否含有He元素;
(4)可以根据氢化物稳定性判断元素非金属性强弱;利用金属与酸反应的剧烈程度判断金属性强弱;
(5)MO2Cl2常温下为深红色液体,熔点低,实验分子晶体,能与CCl4、CS2等非极性溶剂互溶,根据相似相溶原理判断分子极性;
(6)根据相似相溶原理及氨气分子之间存在氢键分析解答;
(7)元素N的低价硫酸盐为FeSO4,少量由元素G、L、E组成的化合物(原子个数比为1:1:1)为KClO,次氯酸根氧化亚铁离子为铁离子,自身被还原为氯离子,铁离子水解得到氢氧化铁沉淀.
(1)稀有气体的电离能最大;同周期随原子序数增大,元素第一电离能呈增大趋势,元素原子核外处于半满、全满时,能力较低,第一电离能高于同周期相邻元素;
(2)HCN结构式为H-C≡N,单键为σ键,三键含有1个σ键、2个π键;
(3)利用光谱分析确定是否含有He元素;
(4)可以根据氢化物稳定性判断元素非金属性强弱;利用金属与酸反应的剧烈程度判断金属性强弱;
(5)MO2Cl2常温下为深红色液体,熔点低,实验分子晶体,能与CCl4、CS2等非极性溶剂互溶,根据相似相溶原理判断分子极性;
(6)根据相似相溶原理及氨气分子之间存在氢键分析解答;
(7)元素N的低价硫酸盐为FeSO4,少量由元素G、L、E组成的化合物(原子个数比为1:1:1)为KClO,次氯酸根氧化亚铁离子为铁离子,自身被还原为氯离子,铁离子水解得到氢氧化铁沉淀.
解答:
解:由元素在周期表中位置,可知A为氢,B为Na,C为碳,D为氮,E为氧,F为氟,G为钾,H为Mg,I为Al,J为Si,K为硫,L为Cl,M为Cr,N为Fe,T为Cu,R为He.
(1)稀有气体He的电离能最大;同周期随原子序数增大,元素第一电离能呈增大趋势,N元素原子核外处于半满、全满,能力较低,第一电离能高于同周期相邻元素,故第一电离能:F>N>O>C,
故答案为:He;F>N>O>C;
(2)HCN结构式为H-C≡N,单键为σ键,三键含有1个σ键、2个π键,故σ键、π键数目之比为1:1,故答案为:1:1;
(3)对太阳光进行光谱分析,确定是否含有He元素,故答案为:对太阳光进行光谱分析;
(4)HF比H2S稳定,说明F元素非金属性比S元素强;取一小段镁条和一小片铝片,用砂纸去掉表面的氧化膜,分别于2 mL 1.0 mol/L盐酸反应,观察产生气体的剧烈程度,可以确定Mg、Al金属性强弱,
故答案为:HF比H2S稳定;取一小段镁条和一小片铝片,用砂纸去掉表面的氧化膜,分别于2 mL 1.0 mol/L盐酸反应,观察产生气体的剧烈程度;
(5)MO2Cl2常温下为深红色液体,熔点低,实验分子晶体,能与CCl4、CS2等非极性溶剂互溶,根据相似相溶原理,可知其属于非极性,故答案为:非极性;
(6)因水是极性溶剂,CH4是非极性分子,NH3是极性分子,且NH3分子与水分子间还可形成氢键,故氨气易溶于水,而甲烷难溶于水,
故答案为:因水是极性溶剂,CH4是非极性分子,NH3是极性分子,且NH3分子与水分子间还可形成氢键;
(7)元素N的低价硫酸盐为FeSO4,少量由元素G、L、E组成的化合物(原子个数比为1:1:1)为KClO,次氯酸根氧化亚铁离子为铁离子,自身被还原为氯离子,铁离子水解得到氢氧化铁沉淀,反应离子方程式为:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-,现象为:有红褐色沉淀产生,溶液变黄色,
故答案为:有红褐色沉淀产生,溶液变黄色;6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-.
(1)稀有气体He的电离能最大;同周期随原子序数增大,元素第一电离能呈增大趋势,N元素原子核外处于半满、全满,能力较低,第一电离能高于同周期相邻元素,故第一电离能:F>N>O>C,
故答案为:He;F>N>O>C;
(2)HCN结构式为H-C≡N,单键为σ键,三键含有1个σ键、2个π键,故σ键、π键数目之比为1:1,故答案为:1:1;
(3)对太阳光进行光谱分析,确定是否含有He元素,故答案为:对太阳光进行光谱分析;
(4)HF比H2S稳定,说明F元素非金属性比S元素强;取一小段镁条和一小片铝片,用砂纸去掉表面的氧化膜,分别于2 mL 1.0 mol/L盐酸反应,观察产生气体的剧烈程度,可以确定Mg、Al金属性强弱,
故答案为:HF比H2S稳定;取一小段镁条和一小片铝片,用砂纸去掉表面的氧化膜,分别于2 mL 1.0 mol/L盐酸反应,观察产生气体的剧烈程度;
(5)MO2Cl2常温下为深红色液体,熔点低,实验分子晶体,能与CCl4、CS2等非极性溶剂互溶,根据相似相溶原理,可知其属于非极性,故答案为:非极性;
(6)因水是极性溶剂,CH4是非极性分子,NH3是极性分子,且NH3分子与水分子间还可形成氢键,故氨气易溶于水,而甲烷难溶于水,
故答案为:因水是极性溶剂,CH4是非极性分子,NH3是极性分子,且NH3分子与水分子间还可形成氢键;
(7)元素N的低价硫酸盐为FeSO4,少量由元素G、L、E组成的化合物(原子个数比为1:1:1)为KClO,次氯酸根氧化亚铁离子为铁离子,自身被还原为氯离子,铁离子水解得到氢氧化铁沉淀,反应离子方程式为:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-,现象为:有红褐色沉淀产生,溶液变黄色,
故答案为:有红褐色沉淀产生,溶液变黄色;6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-.
点评:本题是对物质结构的考查,题目综合性强,需要学生熟练掌握基础知识,(7)中为易错点、难点,难度中等.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案
相关题目
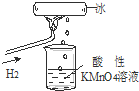 我校化学兴趣小组做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.则该条件下( )
我校化学兴趣小组做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.则该条件下( )| A、生成的水分子化学性质比较活泼 |
| B、H2燃烧生成了具有氧化性的物质 |
| C、H2被冷却为液态氢,液氢的水溶液具有还原性 |
| D、H2燃烧的产物中可能含有一定量的H2O2 |
下列实验问题的处理方法中,正确的是( )
| A、实验中不慎打破温度计,可用吹风机加快水银的蒸发 |
| B、在气体发生装置上直接点燃甲烷气体时,必须先检验甲烷的纯度 |
| C、实验结束后,将废液倒入下水道排出实验室,以免污染实验室 |
| D、燃着的酒精灯不慎碰翻失火,应立即用水扑灭 |
某有机物的结构简式为HCOOCH2CH═CH2,它不具有的官能团是( )
A、 |
B、 |
C、 |
D、 |
 维生素C的结构如图,现有①氯化氢②溴水③纯碱溶液④乙醇⑤酸性高锰酸钾溶液⑥冰醋酸,判断在一定条件下,能与该物质反应的是( )
维生素C的结构如图,现有①氯化氢②溴水③纯碱溶液④乙醇⑤酸性高锰酸钾溶液⑥冰醋酸,判断在一定条件下,能与该物质反应的是( )| A、①②⑤⑥ | B、③④⑤⑥ |
| C、②③④⑥ | D、全部 |
某溶液中可能含有Na+、Al3+、Ba2+、SO42-、I-、S2-中的几种.分别取样进行以下实验:
①用pH计测试,溶液显弱酸性;②加新制氯水和淀粉溶液无明显现象.为确定该溶液的组成,还需检验的离子是( )
①用pH计测试,溶液显弱酸性;②加新制氯水和淀粉溶液无明显现象.为确定该溶液的组成,还需检验的离子是( )
| A、Na+ |
| B、SO42-,Na+ |
| C、S2-,SO42-,Na+ |
| D、Al3+ |
室温下在一定体积某浓度的Ba(NO3)2溶液中逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测定溶液pH=2,若忽略两溶液混合时的体积变化,则稀硫酸的体积与Ba(NO3)2溶液的体积之比是( )
| A、1:10 | B、1:9 |
| C、10:1 | D、9:1 |
常温下,下列溶液中C(H+)最大的是( )
| A、pH=0的溶液 |
| B、0.04 mol?L-1H2SO4 |
| C、0.5 mol?L-1HCl |
| D、0.5 mol?L-1CH3COOH |
下列反应既是离子反应,又是氧化还原反应的是( )
| A、氯化钠溶液中滴入硝酸银溶液 |
| B、铁片置于硫酸铜溶液中 |
| C、铁在氧气中燃烧 |
| D、二氧化碳通入澄清石灰水中 |