题目内容
常温下,下列溶液中C(H+)最大的是( )
| A、pH=0的溶液 |
| B、0.04 mol?L-1H2SO4 |
| C、0.5 mol?L-1HCl |
| D、0.5 mol?L-1CH3COOH |
考点:电解质在水溶液中的电离,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:A、pH=0的溶液中氢离子浓度为1mol/L;
B、0.04mol/L的硫酸溶液中氢离子浓度为0.08mol/L;
C、0.5mol/L的盐酸溶液中氢离子浓度为0.5mol/L;
D、醋酸是弱酸,0.5mol/L的醋酸溶液中氢离子浓度小于0.5mol/L;
B、0.04mol/L的硫酸溶液中氢离子浓度为0.08mol/L;
C、0.5mol/L的盐酸溶液中氢离子浓度为0.5mol/L;
D、醋酸是弱酸,0.5mol/L的醋酸溶液中氢离子浓度小于0.5mol/L;
解答:
解:A、pH=0的溶液中氢离子浓度为1mol/L;
B、0.04mol/L的硫酸溶液中氢离子浓度为0.08mol/L;
C、0.5mol/L的盐酸溶液中氢离子浓度为0.5mol/L;
D、醋酸是弱酸,0.5mol/L的醋酸溶液中氢离子浓度小于0.5mol/L;
所以氢离子浓度最大的为A;
故选A.
B、0.04mol/L的硫酸溶液中氢离子浓度为0.08mol/L;
C、0.5mol/L的盐酸溶液中氢离子浓度为0.5mol/L;
D、醋酸是弱酸,0.5mol/L的醋酸溶液中氢离子浓度小于0.5mol/L;
所以氢离子浓度最大的为A;
故选A.
点评:本题考查了溶液中氢离子浓度的计算,题目难度不大.

练习册系列答案
相关题目
下列实验仪器中,常用于物质分离的是( )
①容量瓶 ②漏斗 ③量筒 ④蒸馏烧瓶 ⑤分液漏斗 ⑥胶头滴管.
①容量瓶 ②漏斗 ③量筒 ④蒸馏烧瓶 ⑤分液漏斗 ⑥胶头滴管.
| A、①③⑤ | B、②④⑤ |
| C、③④⑥ | D、①②⑥ |
下列说法正确的是( )
| A、等质量的铝分别投入过量的稀盐酸和NaOH溶液中,反应生成的气体在相同条件下体积相等 |
| B、金属单质与水反应都生成对应的碱和氢气 |
| C、活泼的金属或较活泼的金属都能与酸反应,但不能与碱反应 |
| D、由于钠比较活泼,所以它能从溶液中置换出金属活动顺序表中钠后面的金属 |
室温下向10mL c(H+)=10-3 mol?L-1的醋酸溶液中加水稀释后,下列说法正确的是( )
| A、溶液中导电粒子的数目减少 | ||
B、溶液中
| ||
| C、醋酸的电离程度增大,c(OH-)亦增大 | ||
| D、再加入10 mL c(OH-)=10-3 mol?L-1的NaOH溶液,醋酸与NaOH恰好完全反应 |
已知I-、Fe2+、SO2和H2O2均有还原性,在酸性溶液中还原能力的强弱顺序为:H2O2<Fe2+<I-<SO2,则下列反应不能发生的是( )
| A、2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
| B、H2O2+H2SO4═SO2↑+O2↑+2H2O |
| C、I2+SO2+2H2O═H2SO4+2HI |
| D、2Fe3+2I-═2Fe2++I2 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、14g乙烯和丁烯的混合物中含有的原子总数为3NA个 |
| B、标准状况下,22.4L己烷中共价键数目为19NA |
C、1mol苯乙烯( 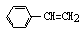 )中含有的C=C数为4NA )中含有的C=C数为4NA |
| D、7g CnH2n中含有的氢原子数目为2NA |