题目内容
下图是元素周期表的一部分,按要求回答下列问题.
(1)元素⑧在元素周期表中位于第 周期,第 族,其原子结构示意图为 .
(2)元素②③④的电负性由大到小的顺序为 (填化学用语,下同),其第一电离能由大到小的顺序为 ,其简单离子半径由大到小的顺序为 .
(3)写出元素⑤的最高价氧化物对应的水化物与元素⑥的最高价氧化物对应的水化物反应的离子方程式 .
(4)写出元素⑦原子的电子排布式 ,元素⑨原子的外围电子排布式 ,元素⑩原子的简化电子排布式 .
(5)元素①-⑩中属于d区的有 .(填元素符号)
(6)元素③的某种氢化物具有强氧化性,写出其电子式 .
(7)元素⑨的可溶性硫酸盐溶液呈酸性,原因 .(用离子方程式表示)
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ||||||||||||||||
| ⑦ | ⑧ | ⑨ | ⑩ | ||||||||||||||
(2)元素②③④的电负性由大到小的顺序为
(3)写出元素⑤的最高价氧化物对应的水化物与元素⑥的最高价氧化物对应的水化物反应的离子方程式
(4)写出元素⑦原子的电子排布式
(5)元素①-⑩中属于d区的有
(6)元素③的某种氢化物具有强氧化性,写出其电子式
(7)元素⑨的可溶性硫酸盐溶液呈酸性,原因
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、N、O、F、Al、Cl、Cr、Fe、Cu、Se元素,
(1)元素⑧是Fe,在元素周期表中位于第四周期,第VIII族,其原子核外有4个电子层、最外层有2个电子;
(2)同一周期元素,电负性随着原子序数的增大而增大,第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
电子层结构相同的离子,其离子半径随着原子序数的增大而减小;
(3)元素⑤的最高价氧化物对应的水化物是Al(OH)3,元素⑥的最高价氧化物对应的水化物是HClO4,二者反应生成高氯酸铝和水;
(4)元素⑦是Cr元素,其原子核外有24个电子,根据构造原理书写其原子的电子排布式,元素⑨是Cu元素,Cu原子的外围电子为3d、4s电子,根据构造原理书写其外围电子排布式,元素⑩是Se元素,其原子核外有34个电子,根据构造原理书写其原子的简化电子排布式;
(5)根据最后排入电子名称确定元素所属区名称;
(6)元素③的某种氢化物具有强氧化性是双氧水,双氧水分子中氢原子和氧原子之间共用一对电子、氧原子和氧原子之间共用一对电子;
(7)硫酸铜是强酸弱碱盐,铜离子水解导致溶液呈酸性.
(1)元素⑧是Fe,在元素周期表中位于第四周期,第VIII族,其原子核外有4个电子层、最外层有2个电子;
(2)同一周期元素,电负性随着原子序数的增大而增大,第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
电子层结构相同的离子,其离子半径随着原子序数的增大而减小;
(3)元素⑤的最高价氧化物对应的水化物是Al(OH)3,元素⑥的最高价氧化物对应的水化物是HClO4,二者反应生成高氯酸铝和水;
(4)元素⑦是Cr元素,其原子核外有24个电子,根据构造原理书写其原子的电子排布式,元素⑨是Cu元素,Cu原子的外围电子为3d、4s电子,根据构造原理书写其外围电子排布式,元素⑩是Se元素,其原子核外有34个电子,根据构造原理书写其原子的简化电子排布式;
(5)根据最后排入电子名称确定元素所属区名称;
(6)元素③的某种氢化物具有强氧化性是双氧水,双氧水分子中氢原子和氧原子之间共用一对电子、氧原子和氧原子之间共用一对电子;
(7)硫酸铜是强酸弱碱盐,铜离子水解导致溶液呈酸性.
解答:
解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、N、O、F、Al、Cl、Cr、Fe、Cu、Se元素,
(1)元素⑧是Fe,在元素周期表中位于第四周期,第VIII族,其原子核外有4个电子层、最外层有2个电子,其原子结构示意图为 ,
,
故答案为:四;Ⅷ; ;
;
(2)同一周期元素,电负性随着原子序数的增大而增大,所以这三种元素电负性大小顺序是F>O>N;
第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,所以这三种元素第一电离能大小顺序是F>N>O;
电子层结构相同的离子,其离子半径随着原子序数的增大而减小,所以这三种简单阴离子的离子半径大小顺序是N3->O2->F-;
故答案为:F>O>N;F>N>O;N3->O2->F-;
(3)元素⑤的最高价氧化物对应的水化物是Al(OH)3,元素⑥的最高价氧化物对应的水化物是HClO4,二者反应生成高氯酸铝和水,离子方程式为Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(4)元素⑦是Cr元素,其原子核外有24个电子,根据构造原理知其原子的电子排布式为1s22s22p63s23p63d54s1,
元素⑨是Cu元素,Cu原子的外围电子为3d、4s电子,根据构造原理知其外围电子排布式3d104s1,
元素⑩是Se元素,其原子核外有34个电子,根据构造原理书写其原子的简化电子排布式:[Ar]3d104s24p4;
故答案为:1s22s22p63s23p63d54s1;3d104s1;[Ar]3d104s24p4;
(5)根据最后排入电子名称确定元素所属区名称,这几种元素中属于d区的为Cr、Fe,
故答案为:Cr、Fe;
(6)元素③的某种氢化物具有强氧化性是双氧水,双氧水分子中氢原子和氧原子之间共用一对电子、氧原子和氧原子之间共用一对电子,其电子式为 ,故答案为:
,故答案为: ;
;
(7)硫酸铜是强酸弱碱盐,铜离子水解导致溶液呈酸性,水解离子方程式为Cu2++2H2O?Cu(OH)2+2H+,故答案为:Cu2++2H2O?Cu(OH)2+2H+.
(1)元素⑧是Fe,在元素周期表中位于第四周期,第VIII族,其原子核外有4个电子层、最外层有2个电子,其原子结构示意图为
 ,
,故答案为:四;Ⅷ;
 ;
;(2)同一周期元素,电负性随着原子序数的增大而增大,所以这三种元素电负性大小顺序是F>O>N;
第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,所以这三种元素第一电离能大小顺序是F>N>O;
电子层结构相同的离子,其离子半径随着原子序数的增大而减小,所以这三种简单阴离子的离子半径大小顺序是N3->O2->F-;
故答案为:F>O>N;F>N>O;N3->O2->F-;
(3)元素⑤的最高价氧化物对应的水化物是Al(OH)3,元素⑥的最高价氧化物对应的水化物是HClO4,二者反应生成高氯酸铝和水,离子方程式为Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(4)元素⑦是Cr元素,其原子核外有24个电子,根据构造原理知其原子的电子排布式为1s22s22p63s23p63d54s1,
元素⑨是Cu元素,Cu原子的外围电子为3d、4s电子,根据构造原理知其外围电子排布式3d104s1,
元素⑩是Se元素,其原子核外有34个电子,根据构造原理书写其原子的简化电子排布式:[Ar]3d104s24p4;
故答案为:1s22s22p63s23p63d54s1;3d104s1;[Ar]3d104s24p4;
(5)根据最后排入电子名称确定元素所属区名称,这几种元素中属于d区的为Cr、Fe,
故答案为:Cr、Fe;
(6)元素③的某种氢化物具有强氧化性是双氧水,双氧水分子中氢原子和氧原子之间共用一对电子、氧原子和氧原子之间共用一对电子,其电子式为
 ,故答案为:
,故答案为: ;
;(7)硫酸铜是强酸弱碱盐,铜离子水解导致溶液呈酸性,水解离子方程式为Cu2++2H2O?Cu(OH)2+2H+,故答案为:Cu2++2H2O?Cu(OH)2+2H+.
点评:本题考查了元素周期表和周期律的综合应用,涉及盐类水解、电子式、核外电子排布式、电负性、第一电离能等知识点,根据盐的类型、构造原理、元素周期律等知识来分析解答,难点的核外电子排布式的书写,要注意能级交错现象,为易错点.

练习册系列答案
相关题目
下列离子方程式正确的是( )
A、尼泊金酸与碳酸氢钠反应: | ||
| B、醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2=Cu2++2H2O | ||
| C、苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3- | ||
D、乙醛与银氨溶液的反应的离子方程式:CH3CHO+2[Ag(NH3)2]++2OH-
|
下列各组物质中,按单质、化合物、混合物顺序排列的是( )
| A、天然气、酒精、液态氯化氢 |
| B、稀有气体、浓硫酸、纯碱 |
| C、水银、氢氧化钙、民用管道煤气 |
| D、金刚石、铁矿石、大理石 |
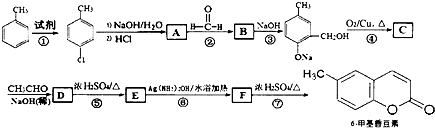
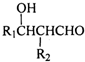 ,其中R1和R2为(烃基或H).请回答下列问题:
,其中R1和R2为(烃基或H).请回答下列问题: 结构且苯环上有2种化学环境的氢原子
结构且苯环上有2种化学环境的氢原子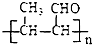 )请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO
)请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO