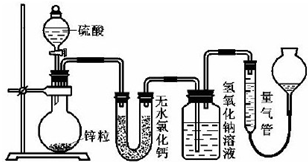
题目内容
4.(1)在标准状况下,将22.4L H2和11.2L O2混合,混合气体的密度为0.5357g/L.(2)常温常压下,某气体的摩尔质量是29.3g•mol-1,密为1.285g•L-1,则该气体的摩尔体积为22.802g/L.
(3)某气体在标准状兄下的密度为1.25g•L-1,该气体的相对分子质量为28.
分析 (1)根据n=$\frac{v}{{v}_{m}}$、m=nM、ρ=$\frac{m}{V}$计算混合气体的密度;
(2)假设取该气体1mol,根据m=nM计算1mol该气体的质量,根据V=$\frac{m}{ρ}$计算其体积,根据气体摩尔体积Vm=$\frac{V}{n}$来计算;
(3)摩尔质量与相对分子质量的数值相等,该气体在标准状况下的密度为1.25g•L-1,根据M=ρVm计算A的相对分子质量.
解答 解:(1)在标准状况下,22.4L H2的物质的量为n=$\frac{v}{{v}_{m}}$=$\frac{22.4L}{22.4L/mol}$=1mol,其质量为:m=nM=1mol×2g/mol=2g,11.2L O2的物质的量为n=$\frac{v}{{v}_{m}}$=$\frac{11.2L}{22.4L/mol}$=0.5mol,其质量为:m=nM=0.5mol×32g/mol=16g,混合气体的密度为ρ=$\frac{m}{V}$=$\frac{16g+2g}{33.6L}$≈0.5357g/L,
故答案为:0.5357g/L;
(2)假设取该气体1mol,m=nM=1mol×29.3g•mol-1=29.3g,其体积为:V=$\frac{m}{ρ}$=$\frac{29.3g}{1.285g/L}$≈22.802g/L,
故答案为:22.802g/L;
(3)在标准状况下,Vm=22.4L/mol,该气体在标准状况下的密度为1.25g•L-1,M=ρVm=1.25g•L-1×22.4L/mol=28g/mol,摩尔质量与相对分子质量的数值相等,则A的相对分子质量为28,
故答案为:28.
点评 本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.

| A. | 需要使用托盘天平称量Na2CO3•10H2O晶体2.86g | |
| B. | 将称量好的Na2CO3•10H2O晶体放入烧杯中,加入100mL蒸馏水,搅拌、溶解 | |
| C. | 转移溶液时应使用玻璃棒引流,且玻璃棒末端应靠在容量瓶刻度线下方 | |
| D. | 定容时,俯视刻度线会使所配制溶液的物质的量浓度偏低 |
| A. |  给液体加热 | B. |  除去CO中的CO2 | C. |  称量 | D. |  稀释浓硫酸 |
| A. | 氯气通入淀粉碘化钾溶液中,溶液变蓝,氧化性:Cl2>I2 | |
| B. | 久置的氯水最终变为稀盐酸 | |
| C. | NaClO溶液的漂白原理与Na202相同,与SO2不同 | |
| D. | 无色溶液C中加入AgN03溶液,产生白色沉淀,再加入稀盐酸,沉淀不消失,则无色溶液C中一定含有Cl- |
| A. | 红色 | B. | 橙色 | C. | 黄色 | D. | 无法判断 |
| pH范围 | >7 | <7 |
| 产物 | NO3- | NO、N2O、N2中的一种 |
| A. | 碱性条件下,NaNO2与NaClO反应的离子方程式为NO2-+ClO-═NO3-+Cl- | |
| B. | 向冷的NaNO2溶液中通入CO2可得到HNO2 | |
| C. | 向冷的NaNO2溶液中加入稀硫酸可得到HNO2 | |
| D. | 向冷的NaNO2溶液中加入滴有淀粉的氢碘酸,溶液变蓝色 |
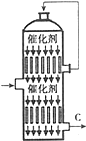 硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.(1)以黄铁矿为原料生产SO2时反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉中进行(填设备名称);
(2)某科研小组测得某硫酸工厂生产工厂中SO2的平衡转化率与外部条件的关系如下表所示,则生产过程中,最适合的生产条件是1个大气压、400℃;
| 压强 (Pa) 温度 (℃) | 1.013×105 | 5.065×105 | 10.13×105 | 15.195×105 |
| 400 | 99.61% | 99.72% | 99.84% | 99.88×105 |
| 500 | 96.75% | 97.67% | 98.52% | 98.94% |
| 600 | 85.20% | 88.97% | 92.76% | 94.68% |
(4)下列做法中,与提高硫酸工业的经济效益无关的是d;
a.适当地对黄铁矿进行粉碎
b.在接触室中使用适当过量的O2
c.利用生产中的余热发电或供暖
d.对废水进行无害化处理后再排放
(5)硫酸工业会产生许多对环境有害的物质,因此无论是工厂厂址的选择还是生产过程中有害成分的处理都要充分考虑环保的要求;
①某市计划建一个硫酸工厂,厂址有A、B、C三个地方可供选择,假设最终该厂建在B地,你认为选择B地建厂的理由是(至少回答两点)B地远离硫酸的消耗中心、B地远离人品稠密的地方;
②将尾气中SO2在一定条件下转化为CaSO4,然后利用焦炭将其转化为CaS(另有一种可燃性气体生成)具有重要的意义,写出CaSO4转化为CaS的化学方程式CaSO4+4C$\frac{\underline{\;高温\;}}{\;}$CaS+4CO;
(6)若用等质量的硫磺,FeS2生产硫酸,假设原料的总利用率均为90%,则二者得到的硫酸质量比为15:8.

| A. | 加入催化剂,该化学反应的活化能和反应热都改变 | |
| B. | b曲线是加入催化剂时的能量变化曲线 | |
| C. | 该反应的热化学方程式为N2(g)+3H2(g)?2NH3(g);△H=-92kJ•mol-1 | |
| D. | 在温度、体积一定的条件下,通入lmol N2和3molH2 反应后放出的热量为Q1kJ,则Q1<92 |