题目内容
6.如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O,下列关于该电池工作时的说法正确的是( )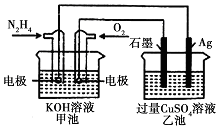
| A. | 该装置工作时,Ag电极上有气体生成 | |
| B. | 甲池和乙池中的溶液的pH均减小 | |
| C. | 甲池中负极反应为N2H4-4e-═N2+4H+ | |
| D. | 当甲池中消耗0.1molN2H4时,乙池中理沦上最多产生6.4g固体 |
分析 甲池能自发的发生氧化还原反应而作原电池,通入肼的电极为负极,通入氧气的电极为正极,负极反应为N2H4-4e-+4OH-=N2+4H2O,正极反应为O2+4e-+2H2O=4OH-,乙池为电解池,阴极Ag反应为 Cu2++2e-=Cu、阳极石墨反应为4OH--4e-=2H2O+O2↑,据此分析解答.
解答 解:A.通入肼的电极为负极,负极与阴极相连,银极为阴极,铜离子得电子生成铜单质,无气体生成,故A错误;
B.甲池生成水,导致溶液中KOH浓度降低,则溶液pH减小,乙池中氢氧根离子放电,导致溶液pH减小,故B正确;
C.甲池负极反应为N2H4-4e-+4OH-=N2+4H2O,氢离子不能在碱性溶液中出现,故C错误;
D.甲池N2H4-4e-+4OH-=N2+4H2O,消耗0.1mol N2H4时,转移0.4mol电子,乙池Cu2++2e-=Cu,产生0.2mol铜,为12.8g固体,故D错误;
故选B.
点评 本题考查了原电池和电解池原理,根据电极反应确定电极上的生成物及溶液pH变化,难点是电极反应式的书写及计算.

练习册系列答案
相关题目
19.四种短周期主族元素X、Y、Z、W的原子序数依次增大,化合物甲由X、Y、Z三种元素组成,25℃时,0.01mol•L-1甲溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1010;Z与W同周期,且W的最高正价与最低负价的代数和为4,下列说法中正确的是( )
| A. | 原子半径:X<Y<Z<W | |
| B. | 最简单氢化物的稳定性:Y>W | |
| C. | Z分别与Y、W组成的化合物中化学键类型均相同 | |
| D. | 粘有W的单质的试管可用酒精洗涤 |
14.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 12gNaHSO4晶体中所含阴离子数目为0.2NA | |
| B. | 23g金属钠与足量O2反应时,转移电子数目一定为NA | |
| C. | 1L 0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA | |
| D. | 标准状况下,11.2L CCl4中含有C-Cl键的数目为2NA |
1.化学在日常生活中应用广泛,下列叙述及对应关系错误的是( )
| 实际应用 | 相应性质 | |
| A | 用含有酸性重铬酸钾溶液的仪器检验酒后驾车 | 乙醇具有还原性 |
| B | 明矾常用于自来水的净化、杀菌消毒 | 明矾可发生水解生成胶状的Al(OH)3 |
| C | BaSO4可作为造影剂检查肠胃道疾病 | BaSO4难溶于水且不与盐酸反应 |
| D | 过氧化钠可用作呼吸面具中的供氧剂 | Na2O2能与CO2反应生成O2 |
| A. | A | B. | B | C. | C | D. | D |
11.化学与生产生话息息相关下列有关说法错误的是( )
| A. | 硅胶可用作食品的抗氧化剂 | |
| B. | 可用热碱水清洗炊具上的油渍 | |
| C. | 铁表面镀锌可增强其抗腐蚀性 | |
| D. | 大量燃烧化石燃料是导致雾霾天气的重要因素之一 |
17.常温下,物质的量浓度相等的下列物质的水溶液,PH最小的是( )
| A. | NaOH | B. | FeCl3 | C. | Na2CO3 | D. | NaCl |




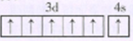 ;CrO2Cl2常温下为深红色液体,能与CCl4互溶,据此判断CrO2Cl2的晶体类型属于分子晶体.
;CrO2Cl2常温下为深红色液体,能与CCl4互溶,据此判断CrO2Cl2的晶体类型属于分子晶体.