题目内容
19.四种短周期主族元素X、Y、Z、W的原子序数依次增大,化合物甲由X、Y、Z三种元素组成,25℃时,0.01mol•L-1甲溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1010;Z与W同周期,且W的最高正价与最低负价的代数和为4,下列说法中正确的是( )| A. | 原子半径:X<Y<Z<W | |
| B. | 最简单氢化物的稳定性:Y>W | |
| C. | Z分别与Y、W组成的化合物中化学键类型均相同 | |
| D. | 粘有W的单质的试管可用酒精洗涤 |
分析 四种短周期主族元素X、Y、Z、W的原子序数依次增大,化合物甲由X、Y、Z三种元素组成,25℃时,0.01mol•L-1甲溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1010,可知c(OH-)=0.01mol/L,则甲为NaOH,结合原子序数可知X为H,Y为O,Z为Na,Z与W同周期,且W的最高正价与最低负价的代数和为4,其最高价为+6价,可知W为S,以此来解答.
解答 解:由上述分析可知,X为H,Y为O,Z为Na,W为S,
A.电子层越多,原子半径越大,同周期从从左向右原子半径减小,则原子半径:X<Y<W<Z,故A错误;
B.非金属性越强,对应氢化物越稳定,则最简单氢化物的稳定性:Y>W,故B正确;
C.Z分别与Y组成的化合物若为过氧化钠,含离子键、共价键,Z与W形成硫化钠只含离子键,故C错误;
D.S微溶于酒精,易溶于CS2,应选CS2洗涤,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意甲为NaOH为突破口,题目难度不大.

练习册系列答案
相关题目
10.已知有机物A.B之间存在转化关系:A(C6H12O2)+H2O$→_{△}^{稀硫酸}$B+HCOOH(已配平)则符合该反应条件的有机物B有(不含立体异构)( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
7.将0.2mol•L-1的KI溶液和0.05mol•L-1 Fe2(SO4)3溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡2Fe3++2I-═2Fe2++I2的是( )
| 实验编号 | 实验操作 | 实验现象 |
| ① | 滴入KSCN溶液 | 溶液变红色 |
| ② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
| ③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
| ④ | 滴入淀粉溶液 | 溶液变蓝色 |
| A. | ②和④ | B. | ①和③ | C. | ③和④ | D. | ① |
14.下列说法正确的是( )
| A. | 化学反应中,化学能全部转化为热能 | |
| B. | 已知C(s)+$\frac{1}{2}$O2(g)═CO(g),△H=-110.5kJ•mol-1,则碳的燃烧热为-110.5kJ•mol-1 | |
| C. | 测定中和热时,用铜制搅拌棒代替环形玻璃搅拌棒不影响测定结果 | |
| D. | 反应C(s)+CO2(g)═2CO(g)△H>0在较高温度下能自发进行 |
4. 乙苯(
乙苯(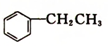 )在有机合成中占有重要的地位,有着广泛的用途.
)在有机合成中占有重要的地位,有着广泛的用途.
已知:① (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1
(g)△H1=-54kJ•mol-1
② (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1
(g)△H2=-121kJ•mol-1
③H2(g)+Cl2(g)═2HCl(g),△H3=-185kJ•mol-1
④相关化学键的键能数据如表所示:
请回答:
(1)根据化学反应原理,缩小容器容积对反应②的影响为缩小容器容积反应速率加快,平衡正向进行,反应物转化率增大;
(2)根据反应①和表中数据计算,x=615;
(3) (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H4
(g)+HCl(g)△H4
①△H4=-118KJ/mol;
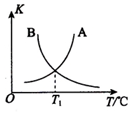
②该反应正、逆反应平衡常数与温度的关系如图所示,其中表示正反应平衡常数K正的曲线为B(填“A”或“B”),理由为反应正反应为放热反应,升温平衡逆向进行平衡常数减小;
③T1℃时,该反应的平衡常数K=1,该温度下,起始向容积为10L的容积可变的密闭容器中充入1mol (g)、2mol Cl2(g)、1mol
(g)、2mol Cl2(g)、1mol  (g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
(g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
 乙苯(
乙苯(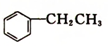 )在有机合成中占有重要的地位,有着广泛的用途.
)在有机合成中占有重要的地位,有着广泛的用途.已知:①
 (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1
(g)△H1=-54kJ•mol-1②
 (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1
(g)△H2=-121kJ•mol-1③H2(g)+Cl2(g)═2HCl(g),△H3=-185kJ•mol-1
④相关化学键的键能数据如表所示:
| 化学键 | C-H | C-C | C=C | C-Cl | H-Cl |
| 键能/(kJ•mol-1) | 412 | 348 | X | 341 | 432 |
(1)根据化学反应原理,缩小容器容积对反应②的影响为缩小容器容积反应速率加快,平衡正向进行,反应物转化率增大;
(2)根据反应①和表中数据计算,x=615;
(3)
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H4
(g)+HCl(g)△H4①△H4=-118KJ/mol;
②该反应正、逆反应平衡常数与温度的关系如图所示,其中表示正反应平衡常数K正的曲线为B(填“A”或“B”),理由为反应正反应为放热反应,升温平衡逆向进行平衡常数减小;
③T1℃时,该反应的平衡常数K=1,该温度下,起始向容积为10L的容积可变的密闭容器中充入1mol
 (g)、2mol Cl2(g)、1mol
(g)、2mol Cl2(g)、1mol  (g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
(g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
6.如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O,下列关于该电池工作时的说法正确的是( )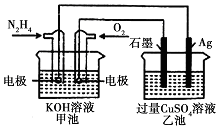

| A. | 该装置工作时,Ag电极上有气体生成 | |
| B. | 甲池和乙池中的溶液的pH均减小 | |
| C. | 甲池中负极反应为N2H4-4e-═N2+4H+ | |
| D. | 当甲池中消耗0.1molN2H4时,乙池中理沦上最多产生6.4g固体 |




