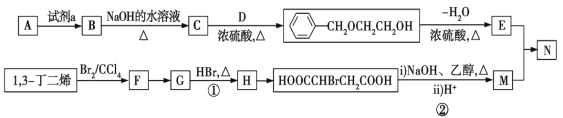
题目内容
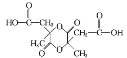
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,X比Y的原子系数小1,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A.Y原子能形成四核18电子的电中性分子
B.元素非金属性的顺序为X>Y>Z
C.W的单质与氧气反应不能产生含共价键的化合物
D.该新化合物中Y不满足最外层8电子稳定结构
【答案】A
【解析】
该化合物由阴、阳离子构成,说明它是离子化合物。从该化合物的结构式看出,W为金属元素;1个Z原子形成1个共价键,说明Z原子最外层有1个或7个电子;1个X原子形成4个共价键,说明X原子最外层有4个电子;Y原子形成2个共价键,阴离子得1个电子,说明Y原子最外层有5个电子;Z核外最外层电子数是X核外电子数的一半,则Z为Cl,X为Si元素;W、X、Y、Z为同一短周期元素,则W为Na,Y为P,据此解答。
根据分析可知,W、X、Y、Z分别为Na、Si、P、Cl元素。
A.Y为P,PH3为四核18电子的电中性分子,故A正确;
B.X、Y、Z分别为Si、P、Cl,同周期从左到右,元素的非金属性逐渐增强,故非金属性X<Y<Z,故B错误;
C.W为Na,Na和氧气在点燃条件下生成Na2O2,含有共价键,故C错误;
D.2个硅原子和1个P原子形成2个共价键,阴离子得到1个电子,所以该化合物中磷原子最外层达到8电子稳定结构,故D错误。
答案选A。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】已知:① X、Y、Z、W、R、Q为原子序数依次增大的短周期元素。X 是所有元素中原子半径最小的元素,Y是形成化合物种类最多的元素,W的最外层电子数是次外层电子数的3倍,Q与W同主族,Y、R原子的最外层电子数之和等于Z的最外层电子数。
②莱纳斯·卡尔·鲍林在1932年提出electronegativity作为元素原子在化合物某种性质的标度,electronegativity的大小可以判断元素金属性与非金属性强弱,下表列出部分短周期元素的Electronegativity的值。
元素 | X | Y | Z | W | R | Q |
electronegativity | 2.1 | 2.5 | 3.0 | 3.5 | 0.9 | 2.5 |
元素 | Mg | Li | Al | Cl | P | Be |
electronegativity | 1.2 | 1.0 | 1.5 | 3.0 | 2.1 | 1.5 |
请回答下列问题(涉及X、Y、Z、W、R、Q时,用元素符号表示):
(1)根据上表给出的数据,可知元素的electronegativity越大,__(填“金属性”或“非金属性”)越强。
(2)元素Q在周期表中的位置为_________。
(3)W、R、Q单核简单离子半径由大到小排列顺序为______。
(4)元素X、Z、W之间能形成多种10电子微粒,请写出反应物和产物均为X、Z、W之间形成的10电子微粒的一个离子方程式______________。
(5)一种由元素W、R组成的白色固体化合物,其电子式为_______________。
(6)试比较稳定性:X2W_____ X2Q;沸点:X2W_____ X2Q (填“<”或“>”)。
(7)元素 X、Y、Z、W、R、Q中的两种元素可形成原子个数比为1∶2的共价化合物,则这两种元素的原子序数之差不可能是_________。
A.2 B.4 C.5 D.7