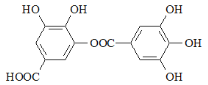
题目内容
【题目】从石油中裂解获得A是目前工业上生产A的主要途径,图中的N是高分子化合物。以A和1,3-丁二烯为原料合成N的流程如图所示。
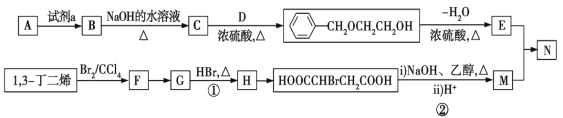
请回答下列问题:
(1)D物质的名称为________;B→C的化学方程式为_______________________。
(2)G中官能团的名称为_____________,C→E涉及的反应类型为________________。
(3)在催化剂存在下,E和M等物质的量发生聚合反应,N的结构简式为______________。
(4)E有多种同分异构体,符合下列条件的同分异构体最多有_____种(不考虑立体异构)。
①可与Na2CO3溶液反应;②分子中只有一个环状结构。
其中核磁共振氢谱中峰数最少的有机物的结构简式为____________________。
(5)试以异戊二烯CH2=C(CH3)CH=CH2为原料(其他无机试剂任选),设计制备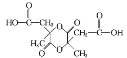 的合成路线,写出合成路线流程图(合成路线流程图可仿照题干)____________________。
的合成路线,写出合成路线流程图(合成路线流程图可仿照题干)____________________。
【答案】苯甲醇 ![]() +2NaOH
+2NaOH![]()
![]() +2NaX(X代表卤素原子) 羟基、碳碳双键 取代反应、消去反应
+2NaX(X代表卤素原子) 羟基、碳碳双键 取代反应、消去反应  或
或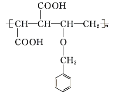 19
19 ![]()
![]()
![]()
![]()

![]()
![]()
![]()

![]()
【解析】
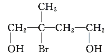
由“从石油中裂解获得A是目前工业上生产A的主要途径”推出A为CH2=CH2,由题给流程图可推出试剂a为卤素单质,B为CH2XCH2X(X代表卤素原子),C为HOCH2CH2OH,D为苯甲醇(![]() ),E为
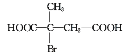
),E为![]() ;F为CH2BrCH=CHCH2Br,G为HOCH2CH=CHCH2OH,H为HOCH2CHBrCH2CH2OH,M为HOOCCH=CHCOOH,N为
;F为CH2BrCH=CHCH2Br,G为HOCH2CH=CHCH2OH,H为HOCH2CHBrCH2CH2OH,M为HOOCCH=CHCOOH,N为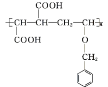 或
或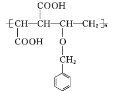 。据此解答。
。据此解答。
(1)D为苯甲醇;B水解得到C:![]() +2NaOH
+2NaOH![]()
![]() +2NaX(X代表卤素原子)。
+2NaX(X代表卤素原子)。
故答案为:苯甲醇;![]() +2NaOH
+2NaOH![]()
![]() +2NaX(X代表卤素原子);
+2NaX(X代表卤素原子);
(2)G中的官能团为羟基和碳碳双键;C和D首先发生取代反应,生成的产物再发生消去反应得到E。
故答案为:羟基、碳碳双键;取代反应、消去反应;
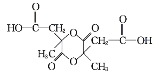
(3)E和M等物质的量聚合可以得到 或
或 。
。
故答案为: 或
或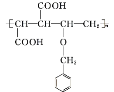 ;
;
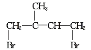
(4)由条件①、②可知,含有酚羟基,当E的同分异构体的苯环上有3个取代基,即—CH3、—OH、—CH=CH2时有10种结构,当E的同分异构体的苯环上有两个取代基,即—OH、—CH=CHCH3或—OH、—CH2CH=CH2或—OH、—C(CH3)=CH2时,各有3种结构,共19种,其中核磁共振氢谱中峰数最少的有机物的结构简式为![]() 。
。
故答案为:19;![]() ;
;
(5)以异戊二烯CH2=C(CH3)CH=CH2为原料(其他无机试剂任选),设计制备 ,可先与Br2发生加成反应生成
,可先与Br2发生加成反应生成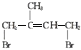 ,然后水解生成
,然后水解生成 ,再与HBr发生加成反应生成
,再与HBr发生加成反应生成 ;
; 氧化得到
氧化得到 ,经水解后酸化生成
,经水解后酸化生成 ,最后在浓硫酸、加热条件下发生酯化反应得到
,最后在浓硫酸、加热条件下发生酯化反应得到 ,反应的流程为:
,反应的流程为:
![]()
![]()

![]()

![]()

![]()

![]()

![]()
 ,
,
故答案为:![]()
![]()

![]()

![]()

![]()

![]()

![]()
 。
。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是________(填元素符号)。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是________,其氢化物的电子式是_________。
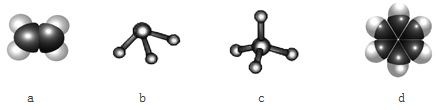
(3)元素①和②可以形成多种化合物。下图模型表示的分子中,不可能由①和②形成的是_______(填序号)。
(4)比较元素②、③的最高价氧化物对应水化物的酸性:______>______(填化学式)。说明你判断的理由:_________。
(5)主族元素砷(As)的部分信息如图所示。
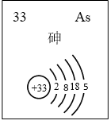
i.砷(As)在周期表中的位置是______。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. ③的气态氢化物的还原性大于砷的气态氢化物的还原性
(6)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。
已知:常温下浓盐酸与高锰酸钾反应生成氯气。
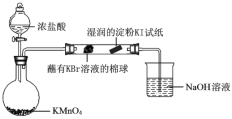
打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br > I,并说明理由_________。