题目内容
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用
(1)基态Fe3+的电子排布式为________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
(3)FeCl3的熔点为306℃,沸点为315℃ FeCl3的晶体类型是______。FeSO4常作补铁剂,SO42-的立体构型是_______。
(4)基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含σ键数目为_______,与CO互为等电子体的离子是__________(填化学式,写一种)
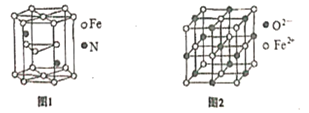
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为______。
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-1,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短间距为_______ pm。
【答案】1s22s22p63s23p63d5或[Ar] 3d5 N>O>S sp2 分子晶体 正四面体形 10NA CN- 或C22- 3∶1 12 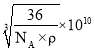
【解析】
(1)铁原子序数为26,核外电子排布式为1s22s22p63s23p63d64s2,失去4s能级上2个电子、3d能级上1个电子生成Fe3+;
(2)根据同一周期元素的第一电离能随着原子序数的增大呈增大趋势,同一主族元素的第一电离能随着原子序数的增大而减小,结合半充满和全充满较为稳定分析判断;苯酚为苯上的一个H原子被-OH取代而成,苯和苯酚均为平面结构,据此分析判断碳原子的杂化方式;
(3)分子晶体熔沸点较低且熔融不导电,据此判断晶体类型;根据SO42-中心原子含有的共价键个数与孤电子对个数之和确定其空间构型和杂化方式;
(4)Fe与CO形成5个配位键,属于σ键,CO分子中形成1个σ键;原子数目相等、价电子总数相等的微粒互为等电子体;
(5)根据均摊法分析计算计算铁、氮的微粒个数之比;
(6)依据图2可知,上、中、下三层各有4个氧离子与中心的氧离子紧邻且等距离,而氧化亚铁中氧离子、亚铁离子个数比为1∶1,所以有12个二价铁离子与二价铁离子相邻且等距离;根据均摊法计算晶胞中二价铁离子、氧离子数目,依据氧化亚铁晶体的密度计算Fe2+与O2-最短核间距。
(1)铁原子失去4s能级上2个电子、3d能级上1个电子生成Fe3+,其核外电子排布式为1s22s22p63s23p63d5,简化的电子排布式为[Ar]3d5;故答案为:1s22s22p63s23p63d5或[Ar]3d5;
(2)同一周期元素的第一电离能随着原子序数的增大呈增大趋势,同一主族元素的第一电离能随着原子序数的增大而减小即第一电离能O>S,氮元素2p能级处于半满稳定状态,能量低,氮元素的第一电离能高于同周期相邻元素第一电离能,所以第一电离能N>O>S;苯酚为苯上的一个H原子被-OH取代而成,苯和苯酚均为平面结构,C原子采取sp2杂化,故答案为:N>O>S;sp2;
(3)FeCl3的熔点为306℃,沸点为315℃,据此可知氯化铁熔沸点较低,则氯化铁属于分子晶体;SO42-离子中S原子的价层电子对数=4+![]() =4,即含有4个σ键、没有孤电子对,所以其VSEPR模型和立体构型均是正四面体,故答案为:分子晶体;正四面体形;
=4,即含有4个σ键、没有孤电子对,所以其VSEPR模型和立体构型均是正四面体,故答案为:分子晶体;正四面体形;
(4)Fe与CO形成5个配位键,属于σ键,CO分子中形成1个σ键,故Fe(CO)5分子含有10个σ键,则1molFe(CO)5分子中含10molσ键;原子数目相等、价电子总数相等的微粒互为等电子体,与CO互为等电子体的离子有CN-、C22-等,故答案为:10 NA;CN-或C22-;
(5)氮化铁晶体为六棱柱:顶点贡献率为![]() ,面点贡献率为
,面点贡献率为![]() ,依据晶胞结构可知,12个铁原子位于顶点,2个铁原子位于面心,3个铁原子位于体内,2个氮原子位于体内,1个晶胞含有铁微粒数为:12×
,依据晶胞结构可知,12个铁原子位于顶点,2个铁原子位于面心,3个铁原子位于体内,2个氮原子位于体内,1个晶胞含有铁微粒数为:12×![]() +2×
+2×![]() +3=6、含氮原子数为2,所以该晶体中铁、氮的微粒个数之比为6∶2=3∶1,故答案为:3∶1;
+3=6、含氮原子数为2,所以该晶体中铁、氮的微粒个数之比为6∶2=3∶1,故答案为:3∶1;
(6)依据图2可知,上、中、下三层各有4个氧离子与中心的氧离子紧邻且等距离,而氧化亚铁中氧离子、亚铁离子个数比为1∶1,所以有12个二价铁离子与二价铁离子相邻且等距离;1个氧化亚铁晶胞含有亚铁离子数目为:8×![]() +6×
+6×![]() =4,含有氧离子数目为:12×
=4,含有氧离子数目为:12×![]() +1=4,所以1个氧化亚铁晶胞含有4个“FeO”微粒,晶胞质量m=
+1=4,所以1个氧化亚铁晶胞含有4个“FeO”微粒,晶胞质量m=![]() g,设Fe2+与O2-最短核间距为xpm,则晶胞边长为2xpm,晶胞体积V=(2x×10-10)3cm3,氧化亚铁晶体的密度ρ=
g,设Fe2+与O2-最短核间距为xpm,则晶胞边长为2xpm,晶胞体积V=(2x×10-10)3cm3,氧化亚铁晶体的密度ρ=![]() =
=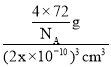 ,解得x=
,解得x=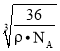 ×1010,故答案为:12;
×1010,故答案为:12;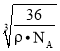 ×1010。
×1010。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案