题目内容
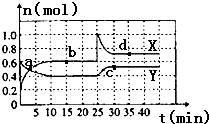 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入容积为2L的恒温密闭容器中,各组分物质的量随时间变化关系如图所示.
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入容积为2L的恒温密闭容器中,各组分物质的量随时间变化关系如图所示.(1)图中共有两条曲线X和Y,其中曲线X表示
物质的量随时间的变化.前10min内用NO2表示的化学反应
速率v(NO2)=
(2)①15min时,反应:2NO2(g)?N2O4(g),b点的平衡常数K=
②25min时X线变化的原因是
③35min时,反应2NO2(g)?N2O4(g)在d点的平衡常数K(d)
(填“>”“=”或“<”)
(3)关于2NO2(g)?N2O4(g),结合该图象判断下列说法正确的是
A.a点时反应已达到平衡
B.b点与d点时该反应速率大小相等
C.c点与d点时该反应速率大小相等
D.d点容器内的压强比b点大.
考点:化学平衡的计算
专题:
分析:(1)据图象分析X与Y的变化量可知X与Y分别是二氧化氮和四氧化二氮;据v=
求算;
(2)①据K=
求算;
②由曲线看出25 min时,NO2的浓度突然增大;
③化学平衡常数只受温度影响,温度不变K不变;
(3)A、a点时二氧化氮和四氧化二氮物质的量相等,还在发生变化;
B、d点时增大了二氧化氮的物质的量,浓度增大速率加快;
C、c点和d点是同一平衡状态,正逆反应速率相等;
D、d点与b点相比,增大了二氧化氮的物质的量,气体总物质的量增多,压强增大.
| ||
| V |
(2)①据K=
| 生成物浓度系数幂次方 |
| 反应物浓度系数幂次方 |
②由曲线看出25 min时,NO2的浓度突然增大;
③化学平衡常数只受温度影响,温度不变K不变;
(3)A、a点时二氧化氮和四氧化二氮物质的量相等,还在发生变化;
B、d点时增大了二氧化氮的物质的量,浓度增大速率加快;
C、c点和d点是同一平衡状态,正逆反应速率相等;
D、d点与b点相比,增大了二氧化氮的物质的量,气体总物质的量增多,压强增大.
解答:
解:(1)据图象分析X与Y的变化量之比为2:1,可知X与Y分别是二氧化氮和四氧化二氮;v=
=
=0.02mol/(L?min),故答案为:NO2;0.02;
(2)①b点时,二氧化氮浓度为0.3mol/L,四氧化二氮的浓度为0.2mol/L,K=
=
=2.22,故答案为:0.22;
②由曲线看出25 min时,NO2的浓度突然增大,可知改变的条件为增大NO2的浓度,即充入0.4molNO2;
故答案为:充入0.4molNO2;
③化学平衡常数只受温度影响,温度不变K不变,所以K(b)=K(d),故答案为:=;
(3)A、a点时二氧化氮和四氧化二氮物质的量相等,但还在发生变化,正逆反应速率不相等,没有达到平衡状态,故A错误;
B、d点时增大了二氧化氮的物质的量,浓度增大速率加快,所以bd点速率不相等,故B错误;
C、c点和d点是同一平衡状态,正逆反应速率相等,故C正确;
D、d点与b点相比,增大了二氧化氮的物质的量,气体总物质的量增多,压强增大故D正确;
故选CD.
| ||
| V |
| ||
| 10min |
(2)①b点时,二氧化氮浓度为0.3mol/L,四氧化二氮的浓度为0.2mol/L,K=
| 生成物浓度系数幂次方 |
| 反应物浓度系数幂次方 |
| 0.2 |
| 0.32 |
②由曲线看出25 min时,NO2的浓度突然增大,可知改变的条件为增大NO2的浓度,即充入0.4molNO2;
故答案为:充入0.4molNO2;
③化学平衡常数只受温度影响,温度不变K不变,所以K(b)=K(d),故答案为:=;
(3)A、a点时二氧化氮和四氧化二氮物质的量相等,但还在发生变化,正逆反应速率不相等,没有达到平衡状态,故A错误;
B、d点时增大了二氧化氮的物质的量,浓度增大速率加快,所以bd点速率不相等,故B错误;
C、c点和d点是同一平衡状态,正逆反应速率相等,故C正确;
D、d点与b点相比,增大了二氧化氮的物质的量,气体总物质的量增多,压强增大故D正确;
故选CD.
点评:本题考查改变外界条件对化学反应速率及化学平衡的影响、化学平衡图象、反应速率计算等,难度中等,侧重于考查学生对化学平衡有关知识的综合运用能力.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
可逆反应A(g)+4B(g)?C(g)+D(g),在四种不同情况下的反应速率如下,其中表示反应进行得最快的是( )
| A、vA=0.15mol/(L?min) |
| B、vB=0.6 mol/(L?min) |
| C、vC=0.4 mol/(L?min) |
| D、vD=0.005 mol/(L?s) |
自来水可以用氯气消毒.有些药品若用自来水配制,则明显会导致药品变质.下列哪些药品不能用自来水配制( )
| A、Na2SO4 |
| B、AgNO3 |
| C、NaCl |
| D、AlCl3 |
下列说法正确的是( )
| A、用坩埚蒸发溶液时直接将水分蒸干 |
| B、分液时下层液体下放,上层液体上倒 |
| C、向待测液中加入盐酸酸化的氯化钡溶液,出现白色沉淀,待测液中一定含有SO42- |
| D、向待测液中加入稀盐酸,生成使澄清的石灰水变浑浊的无色无味的气体,待测液中一定含有CO32- |
 阅读下表中的部分短周期主族元素的相关信息.
阅读下表中的部分短周期主族元素的相关信息.