题目内容
下列四种溶液中,由水电离生成的氢离子浓度之比(①:②:③)是( )
①pH=0的盐酸 ②0.1mol/L的盐酸 ③0.01mol/L的NaOH溶液.
①pH=0的盐酸 ②0.1mol/L的盐酸 ③0.01mol/L的NaOH溶液.
| A、1:10:100 |
| B、0:1:12 |
| C、14:13:12 |
| D、14:13:2 |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:电离平衡为H2O?H++OH-,在水中加入酸或者碱溶液,导致溶液中氢离子或者氢氧根离子浓度增大,抑制了水的电离;酸溶液中氢氧根离子是水电离的,碱溶液中氢离子是水电离,结合Kw=c(H+)×c(OH-)计算该题.
解答:
解:酸溶液中,氢氧根离子是水电离,碱溶液中氢离子是水电离的,水电离的氢离子浓度等于水电离的氢氧根离子都浓度,
①pH=0的盐酸,溶液中氢离子浓度为1mol/L,水电离的氢离子为
mol/L=1×10-14mol/L;
②0.1mol/L盐酸,溶液中氢离子浓度为0.1mol/L,水电离的氢离子为
mol/L=1×10-13mol/L;
③0.01mol/L的NaOH 溶液,溶液中氢离子浓度为
mol/L=1×10-12mol/L;
所以由水电离产生的c(H+)之比①:②:③=1×10-14mol/L:1×10-13mol/L:1×10-12mol/L=1:10:100,
故选A.
①pH=0的盐酸,溶液中氢离子浓度为1mol/L,水电离的氢离子为
| 1×10-14 |
| 1 |
②0.1mol/L盐酸,溶液中氢离子浓度为0.1mol/L,水电离的氢离子为
| 1×10-14 |
| 0.1 |
③0.01mol/L的NaOH 溶液,溶液中氢离子浓度为
| 10-14 |
| 0.01 |
所以由水电离产生的c(H+)之比①:②:③=1×10-14mol/L:1×10-13mol/L:1×10-12mol/L=1:10:100,
故选A.
点评:本题考查了水的电离以及pH的计算,侧重于学生的分析能力和计算能力的考查,题目难度中等.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
T℃时,将NO2和N2O4的混合气体通入容积不变的密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.各组分的浓度随时间的变化如图.下列说法正确的是( )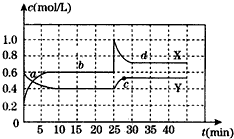

| A、第35min时,NO2的体积分数高于第15min时的体积分数 |
| B、T℃时,N2O4(g)?2NO2(g)的平衡常数为0.9 |
| C、a、b、C、d四点中,气体颜色最浅的是C点 |
| D、0~10min内反应体系对外界放热,25~30min内反应体系从外界吸热 |
下列说法正确的是( )
| A、22.4 L氨气中含氢原子数目为3×6.02×1023 |
| B、1.8g水中所含质子数为0.1×6.02×1023 |
| C、标准状况下,4.48 L的氧气和氮气的混合物含有的分子数目为0.2×6.02×1023 |
| D、80 g苛性钠溶于1L水中,所得溶液的物质的量浓度为2 mol/L |
将Fe和Cu的混合粉末加入到100ml 4mol/L稀硝酸中充分反应后(假设NO是唯一的还原产物):如果加入的Fe和Cu的质量比为7:4,则使HNO3完全反应的金属粉末的最大质量是( )
| A、7.2g | B、8.8g |
| C、9.0g | D、9.6g |
关于强、弱电解质的叙述不正确的是( )
| A、强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 |
| B、同一弱电解质溶液,温度不同时,导电能力不同 |
| C、强电解质在溶液中完全电离,但溶液中存在电离平衡 |
| D、强电解质在固态或液态时,可能不导电 |
下列说法正确的是( )
| A、向0.1mol/L的醋酸和饱和硼酸溶液中滴加等浓度的碳酸钠溶液,均有气体生成 |
| B、向氢氧化镁沉淀中滴加适量的盐酸和氯化铵溶液,沉淀均能溶解 |
| C、实验测定酸碱滴定曲线时,要保证整个过程测试和记录pH的间隔相同 |
| D、Ksp大的难溶电解质一定能转化成Ksp小的难溶电解质,Ksp小的难溶电解质一定不能转化成Ksp大的难溶电解质 |
下列常见材料中属于合金的是( )
| A、硬铝 | B、大理石 |
| C、塑料 | D、合成纤维 |