题目内容
在某温度下,将某NaOH溶液和0.1mol/L的CH3COOH溶液充分混合后,若溶液呈中性,则该混合溶液中有关离子的浓度应满足的关系是( )
| A、c(H+)=c(OH-)=1×10-7mol/L |
| B、c(Na+)>c(CH3COO-) |
| C、c(Na+)<c(CH3COO-) |
| D、c(Na+)-c(CH3COO-)=0 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、溶液呈中性,氢离子浓度和氢氧根离子浓度相同;但温度不是常温,氢离子和氢氧根离子浓度不是1×10-7mol/L;
B、依据溶液中电荷守恒分析判断;
C、依据溶液中电荷守恒分析判断;
D、依据溶液中电荷守恒分析判断.
B、依据溶液中电荷守恒分析判断;
C、依据溶液中电荷守恒分析判断;
D、依据溶液中电荷守恒分析判断.
解答:
解:在某温度下,将某NaOH溶液和0.1mol/L的CH3COOH溶液充分混合后,若溶液呈中性,温度不是常温,溶液中c(H+)=c(OH-)≠10-7mol/L,溶液中存在电荷守恒:c(H+)+c(Na+)=c(OH-)+c(CH3COO-),得到c(Na+)=c(CH3COO-),
故选D.
故选D.
点评:本题考查了电解质溶液中电荷守恒的分析判断,注意离子积常数的应用条件和离子浓度数值,题目较简单.

练习册系列答案
相关题目
将3mol A和1mol B混合于一体积可变的密闭容器P中,以此时的温度、压强和体积作为起始条件,发生了如下反应:3A(g)+B(g)?2C(g)+D(g),达到平衡时C的浓度为w mol/L保持温度和压强不变,按下列四种配比充入容器P中,平衡后C的浓度仍为w mol/L的是( )
| A、6molA+2molB |
| B、3molA+1molB+2molC |
| C、2molC+1molB+1molD |
| D、1molC+2molD |
某溶液用石蕊试液试验显红色,用甲基橙试液显黄色,则该溶液的pH值( )
| A、PH<5 |
| B、4.4<PH<5 |
| C、PH>8 |
| D、3.1<PH<4.4 |
某同学用洗涤过,并已检查不漏水的滴定管进行如下操作:①往滴定管内注入标准液;②用标准液润洗滴定管;③滴定;④滴加指示剂于待测液中.正确的操作顺序是( )
| A、①②③④ | B、③①②④ |
| C、④①②③ | D、②①④③ |
a mol N2与a mol CO相比较,下列叙述中不正确的是( )
| A、质量一定相同 |
| B、所含分子数一定相同 |
| C、所含原子数一定相同 |
| D、气体体积一定相同 |
如图所示各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由快到慢的顺序为( )

| A、⑤②①④③ |
| B、③②⑤④① |
| C、⑤④②③① |
| D、⑤②①③④ |
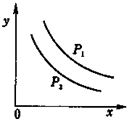 反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断上述反应是
反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断上述反应是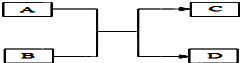 A、B、C、D是初中化学常见物质,它们之间的转化关系(反应的条件未标出)如图所示.已知A是一种碱,常用于改良酸性土壤,C是最常见溶剂.
A、B、C、D是初中化学常见物质,它们之间的转化关系(反应的条件未标出)如图所示.已知A是一种碱,常用于改良酸性土壤,C是最常见溶剂.