题目内容
 如图所示装配仪器,接通电流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生的气体是( )
如图所示装配仪器,接通电流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生的气体是( )| A、Cl2 |
| B、O2 |
| C、H2 |
| D、HCl |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由图可知,碳为阳极,Fe为阴极,电解饱和食盐水,阳极上阴离子放电,阴极上阳离子放电,以此来解答.
解答:
解:由图可知,碳与电源的正极相连,则为阳极,所以Fe为阴极,电解饱和食盐水,阳极上溶液中阴离子放电能力为Cl-大于OH-,碳棒上发生Cl--2e-=Cl2↑,
故选A.
故选A.
点评:本题考查电解食盐水,明确电解原理、离子的放电顺序,发生的电极反应即可解答,题目较简单.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
有氧化铁和氧化铜的混合物a g,加入2mol/L的硫酸溶液50mL时,恰好完全溶解.若将2ag这种混合物在氢气流中加热并充分反应,冷却后剩余固体的质量为( )
| A、0.8g |
| B、1.6ag |
| C、(2a-3.2)g |
| D、(2a-1.6)g |
常温下,下列有关电解质溶液的叙述正确的是( )
| A、等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7 |
| B、pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性 |
| C、pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(已知lg2=0.3) |
| D、将10mLpH=a的盐酸与100mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 |
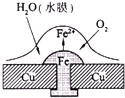 已知铅蓄电池的总反应PbO2+Pb+2H2SO4═2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )
已知铅蓄电池的总反应PbO2+Pb+2H2SO4═2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )| A、如图,铁铆钉发生吸氧腐蚀,在铁钉附近滴加K3[Fe(CN)6]溶液,可观察铁钉附近有蓝色沉淀产生 |
| B、铅蓄电池充电时,阳极电极反应为PbSO4+2H2O-2e-=PbO2+4H++SO42- |
| C、铅蓄电池放电时,电路中每转移2mol电子,消耗1mol硫酸 |
| D、铅蓄电池放电时,内电路硫酸根离子向铅极移动,正极附近溶液的pH增大 |
已知:H2(g)+F2(g)═2HF(g)△H=-270kJ/mol,下列说法不正确的是( )
| A、44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收270 kJ热量 |
| B、1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量大于270 kJ |
| C、相同条件下,1mol氢气与1mol氟气的能量总和高于2mol氟化氢气体的能量 |
| D、2mol H-F键的键能比1mol H-H键和1mol F-F键的键能之和大270 kJ |
下列实验现象的描述错误的是( )
| A、铜片投入到稀硫酸中产生大量的气泡 |
| B、打开盛有浓盐酸的试剂瓶盖时,瓶口出现白雾 |
| C、汞在空气中加热生成红色粉末 |
| D、硫在氧气中燃烧产生蓝紫色火焰 |
为制备干燥、纯净的CO2,将大理石和盐酸反应生成的气体先后通过装有下列物质的两个吸收装置,两个装置中应依次装入( )
| A、饱和Na2CO3溶液;无水CaCl2固体 |
| B、饱和NaHCO3溶液;浓H2SO4 |
| C、浓H2SO4;饱和Na2CO3溶液 |
| D、饱和Na2CO3溶液;稀H2SO4 |
