题目内容
4.密闭容器中,CO与O2的混合气体共1.8mol,点燃充分反应后.混合气体变为1.3mol,求反应前CO与O2的物质的量各为多少?分析 根据反应方程式2CO+O2=2CO2分析,起始混合气体的总量为1.8mol变成1.3mol,通过气体的差量进行计算,讨论剩余气体的可能性进而进行计算.
解答 解:已知反应前后气体体积减少了1.8-1.3=0.5mol
2CO+O2=2CO2△n
2 1 2 1
n(CO) n(O2) 0.5mol
n(CO)=1mol,n(O2)=0.5mol
参加反应的气体总量1+0.5=1.5mol,剩余气体1.8-1.5=0.3mol
①若剩余气体为CO,则n(CO)=1+0.3=1.3mol,n(O2)=0.5mol;
②若剩余气体为O2,则n(CO)=1mol,n(O2)=0.5+0.3=0.8mol;
答:反应前CO物质的量为1.3mol,O2的物质的量为0.5mol,或反应前CO物质的量为1mol,O2的物质的量为0.8mol.
点评 本题考查学生化学方程式计算、差量法计算以及学会问题的讨论和分析,可以从基础中培养学生的化学计算思维模式,本题属于基础题.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
14.对SO2与CO2说法正确的是( )
| A. | 都是极性分子 | B. | 中心原子都采取sp杂化 | ||
| C. | SO2为V形结构,CO2为直线形结构 | D. | S原子和C原子上都没有孤电子对 |
15.吸食毒品对健康、家庭和社会危害极大,下列物质不属于毒品的是( )
| A. | 冰毒 | B. | 大麻 | C. | 海洛因 | D. | 麻黄碱 |
12.下列实验基本操作或对事故的处理方法不正确的是( )
| A. | 给盛有液体的烧瓶加热时,需要加碎瓷片或沸石 | |
| B. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 | |
| C. | 不慎将少量浓硫酸溅到皮肤上,应立即用水冲洗,然后涂抹10%的NaOH溶液 | |
| D. | 中和滴定实验时,不必润洗锥形瓶 |
19.DDT又叫滴滴涕,化学名为双对氯苯基三氯乙烷,化学式(ClC6H4)2CH(CCl3).名称从英文缩写DDT而来,为白色晶体,不溶于水,溶于煤油,可制成乳剂,是有效的杀虫剂.DDT进入食物链,是导致一些食肉和食鱼的鸟接近灭绝的主要原因.因此从70年代后滴滴涕逐渐被世界各国明令禁止生产和使用.
其结构为: ,下列有关说法正确的是( )
,下列有关说法正确的是( )
(手性碳原子为饱和碳原子所连的4个原子或原子团不同)
其结构为:
 ,下列有关说法正确的是( )
,下列有关说法正确的是( )(手性碳原子为饱和碳原子所连的4个原子或原子团不同)
| A. | 属于烃类 | |
| B. | DDT完全燃烧后只产生CO2和H2O两种物质 | |
| C. | 分子无手性碳原子 | |
| D. | 氢核磁共振谱图中有5种位置峰 |
9.某饱和一元醇A中含氧的质量分数为34.8%,该醇的结构简式可能为( )
| A. | CH3OH | B. | C2H5OH | C. | HO-CH2CH2-OH | D. | CH3CH2CH2OH |
1.现有两个热化学反应方程式:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | ①②都属于加成反应 | |
| B. | 在通常条件下,①②都能自发进行 | |
| C. | ①吸热、②放热的事实说明苯环中含有的并不是碳碳双键 | |
| D. | ①②中的所有有机物均可使溴水层褪色,但褪色原理不完全相同 |
18.已知反应mX(g)+nY(g)?qZ(g);△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
| A. | X的正反应速率是Y的逆反应速率的$\frac{m}{n}$倍 | |
| B. | 通入稀有气体使压强增大,平衡将正向移动 | |
| C. | 降低温度,混合气体的平均相对分子质量变小 | |
| D. | 若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m |
19.下列物质的电子式书写正确的是( )
| A. | Cl:Cl | B. | O::C::O | C. | 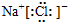 | D. | 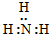 |