题目内容
1.元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值.(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰.相关的反应如下:
4FeCl3+2NH2OH•HCl→4FeCl2+N2O↑+6HCl+H2O

①Fe2+在基态时,核外电子排布式[Ar]3d6
②羟胺中(NH2OH)采用SP3杂化的原子有N、O;羟胺熔沸点较高的原因是因为分子间存在较强的氢键.
③Fe2+与邻啡罗啉形成的配合物中,配位数为6.
④根据价层互斥理论,ClO4-的空间构形为正四面体.
(2)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的
[Cu(NH3)4]SO4晶体,该晶体中含有的化学键类型是离子键、共价键、配位键.
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3 不易与Cu2+形成配离子,其原因是F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,NF3不易与Cu2+形成配离子.
(4)配合物Ni(CO)4常温下呈液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于分子晶体;
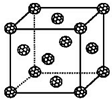
(5)如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60 晶体的空隙中,形成具有良好的超导性的掺杂C60 化合物.现把C60抽象成质点,该晶体的晶胞结构如图所示,若每个四面体空隙填入一个原子,则全部填满C60 晶体的四面体空隙后,所形成的掺杂C60 化合物的化学式为K2C60.
分析 (1)①铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,根据构造原理写出亚铁离子核外电子排布式;
②根据价层电子对互斥理论确定羟胺NH2OH中存在sp3杂化的原子,存在氢键的物质熔沸点升高;
③配位数就是在配位个体中与一个形成体成键的配位原子的总数;
④计算Cl原子价层电子对数、孤对电子数,判断空间结构;
(2)Cu2+提供空轨道,N原子提供孤对电子,形成配位键,N、H原子之间以共价键结合,內界离子与外界离子以离子键结合;
(3)F的电负性比N大,N-F成键电子对向F偏移,不易提供孤电子对;
(4)根据合物Ni(CO)4的性质熔点、溶解性判断;
(5)三个球相切,摆成正三角形,然后上面放第四个球,这样围成的空隙,就叫正四面体空隙,如图所示: 在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个k原子,1+6×$\frac{1}{2}$=4个C60分子,然后求出化学式.
在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个k原子,1+6×$\frac{1}{2}$=4个C60分子,然后求出化学式.
解答 解:(1)①铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,Fe2+在基态时,核外电子排布式为:[Ar]3d6,故答案为:[Ar]3d6;
②羟胺分子中,价层电子对为4的原子有N、O原子,所以采用sp3杂化的原子有N、O原子,羟胺存在氢键,导致羟胺的熔沸点较高,故答案为:N、O,因为分子间存在较强的氢键;
③配位数就是在配位个体中与一个形成体成键的配位原子的总数,所以Fe2+与邻啡罗啉形成的配合物(形成过程如图)中,配位数为6,故答案为:6;
④ClO4-的中Cl原子价层电子对数为4+$\frac{7+1-2×4}{2}$=4、没有孤对电子,其空间结构为正四面体,故答案为:正四面体;
(2)Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键,NH3分子中N、H原子之间以共价键结合,內界离子[Cu(NH3)4]2+与外界离子SO42-以离子键结合,
故答案为:离子键、共价键、配位键;
(3)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子;
故答案为:F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,NF3不易与Cu2+形成配离子;
(4)Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,属于分子晶体,故答案为:分子;
(5)三个球相切,摆成正三角形,然后上面放第四个球,这样围成的空隙,就叫正四面体空隙,如图所示: 在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个K原子,1+6×$\frac{1}{2}$=4个C60分子,故组成K8(C60)4,化学式为K2C60;
在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个K原子,1+6×$\frac{1}{2}$=4个C60分子,故组成K8(C60)4,化学式为K2C60;
故答案为:K2C60.
点评 本题目综合性较大,涉及晶体、化学键、杂化轨道、电负性、晶胞计算等,晶胞计算难度较大,为易错点.

| A. | pH=4的硫酸溶液中c(H+):c(SO42-)等于2:1,稀释10000倍后二者的比值几乎不变 | |
| B. | 由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存 | |
| C. | 1.0×10-3mol/L盐酸溶液的pH=3,则1.0×10-8mol/L盐酸溶液的pH=8 | |
| D. | 某温度下水的离子积为1.0×10-12,等体积的pH=1的H2SO4溶液与pH=11的NaOH溶液混合后溶液呈中性 |
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 | |
| C. | 工业上常用电解C、D的盐溶液来制备C、D元素的单质 | |
| D. | 化合物AE与CE有相同类型的化学键 |
| A. | B的氢化物和E的氢化物能反应,且得到的产物只含有共价键 | |
| B. | C在元素周期表中的位置是第三周期第ⅠA族 | |
| C. | 五种原子中E的原子半径最大 | |
| D. | A的最低价氢化物的沸点>B的最低价氢化物的沸点 |
| A. | 在c(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 无色溶液中:Fe3+、K+、Cl-、H+ | |
| C. | 在pH=12的溶液中:SO32-、CO32-、Na+、K+ | |
| D. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、Na+ |
2FeCl3+2HI═2FeCl2+I2+2HCl; 2Co(OH)3+6HCl═2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH═2Fe(OH)3+2KI; 3I2+6KOH═5KI+KIO3+3H2O
复分解反应:2HSCN+K2CO3═2KSCN+CO2↑+H2O; KCN+CO2+H2O═HCN+KHCO3
热分解反应:4NaClO$\frac{\underline{\;\;△\;\;}}{\;}$3NaCl+NaClO4;NaClO4 $\frac{\underline{\;\;△\;\;}}{\;}$NaCl+2O2↑下列说法不正确是( )
| A. | 氧化性(酸性溶液):Co(OH)3>FeCl3>I2 | B. | 还原性(碱性溶液):I2>Fe(OH)2>KIO3 | ||
| C. | 热稳定性:NaCl>NaClO4>NaClO | D. | 酸性(水溶液):HSCN>H2CO3>HCN |
| A. | 在Cu2O、Cu2S中Cu元素化合价都是+1价 | |
| B. | 反应中Cu元素被氧化,S元素被还原 | |
| C. | Cu2S在反应中既是氧化剂,又是还原剂 | |
| D. | 每生成6.4g Cu,反应中转移0.1 mole- |



