题目内容
4.下列关于配制一定物质的量浓度的溶液说法正确的是( )| A. | 把40gNaOH溶解于1L水中即得到1mol/L的NaOH溶液 | |
| B. | 将4.48LNH3溶解于水配成1L溶液即得到0.2mol/L的氨水溶液 | |
| C. | 配制0.2mol/L的CuSO4溶液480mL,需硫酸铜晶体的质量为25g | |
| D. | 配制1L0.2mol/L的H2SO4溶液,加水定容时仰视刻度线操作,则配出浓度偏高 |
分析 A.40gNaOH的物质的量为1mol,溶于水配成1L溶液,所得溶液中NaOH的物质的量浓度为1mol/L;
B.不是标准状况下,不能使用标准状况下的气体摩尔体积计算;
C.配制480mL溶液,实际上配制的是500mL 0.2mol/L的硫酸铜溶液,硫酸铜晶体的摩尔质量为250g/mol;
D.仰视读数,导致加入的蒸馏水体积偏大,溶液浓度偏低.
解答 解:A.40gNaOH的物质的量为1mol,溶于水配成1L溶液,所得溶液中NaOH的物质的量浓度为1mol/L,体积1L是指溶液的体积,不是溶剂的体积,故A错误;
B.没有告诉在标准状况下,不能使用标准状况下的气体摩尔体积计算4.48L氨气的物质的量,故B错误;
C.配制0.2mol/L的CuSO4溶液480mL,实际上配制的是500mL 0.2mol/L的硫酸铜溶液,需硫酸铜晶体的质量为:250g/mol×0.2mol/L×0.5L=25g,故C正确;
D.配制1L0.2mol/L的H2SO4溶液,加水定容时仰视刻度线操作,导致加入蒸馏水体积偏大,则配出浓度偏低,故D错误;
故选C.
点评 本题考查了溶液配制方法及误差分析,题目难度中等,明确配制溶液的方法与步骤为解答关键,B为易错点,注意标准状况下气体摩尔体积的使用条件,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
14.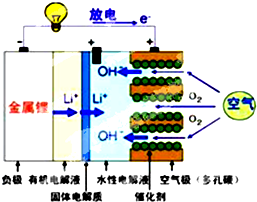 美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )
美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )
 美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )
美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )| A. | 负极反应:Li-e-=Li+,金属锂以锂离子(Li+)的形 式溶于有机电解液,电子供应给导线.溶解的锂离子(Li+)穿过固体电解质移到正极的水性电解液中 | |
| B. | 正极反应:O2+2H2O+4e-=4OH-,在正极的水性电解液中与锂离子(Li+)结合生成水溶性氢氧化锂(LiOH),并能实现锂元素的循环 | |
| C. | 在负极的有机电解液和空气极的水性电解液之间,用只能通过锂离子的固体电解质隔开,以防止两电解液发生混合,而且能促进电池发生反应 | |
| D. | 锂-空气电池至今都未普及,原因是它存在致命缺陷,即固体反应生成物氧化锂(Li2O)在正极堆积,使电解液与空气的接触被阻断,从而导致放电停止 |
15.设NA表示阿伏加德罗常数.下列说法中错误的是( )
| A. | 1mol Cl2参加反应,转移的电子数一定为2NA | |
| B. | 常温常压下,23g NO2与N2O4的混合气体中氮原子数为0.5NA | |
| C. | 标准状况下,22.4L乙烯中含极性共价键数为4NA | |
| D. | 2L 0.1mol•L-1的HClO溶液中含有的H+离子数小于0.2NA |
12.在强酸性溶液中可大量共存的离子组是( )
| A. | Na+、K+、Cl-、F- | B. | Fe2+、ClO-、NO3-、Na+ | ||
| C. | Fe2+、Mg2+、SO42-、Cl- | D. | CO32-、SO42-、Na+、K+ |
 .
.
 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
X、Y、Z、W四种短周期元素在周期表中的位置关系如图: ,工业合成该物质的化学方程式为N2+3H2$?_{催化剂}^{高温高压}$2NH3.
,工业合成该物质的化学方程式为N2+3H2$?_{催化剂}^{高温高压}$2NH3.