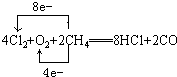题目内容
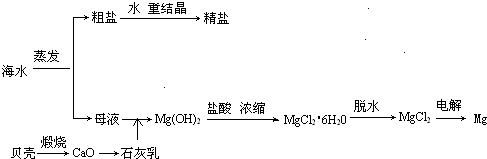
海水的综合利用可以制备金属镁,其流程如图所示: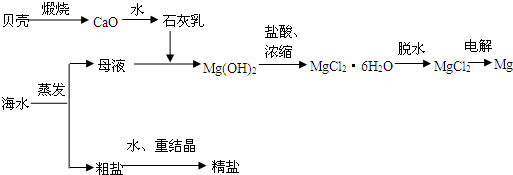
(1)贝壳的主要成份是碳酸钙,请写出由贝壳制取氧化钙的化学方程式(注明反应条件):
(2)海水提取食盐后的母液中含有K+、Na+、Mg2+等阳离子,写出加入石灰乳后生成Mg(OH)2沉淀的离子方程式:
(3)写出用电解熔融的氯化镁制镁的化学方程式
A.H2B.CO2C.O2 D.空气.
分析:(1)碳酸钙在高温条件下分解生成CaO与二氧化碳;
(2)Mg2+离子与石灰乳反应得到Mg(OH)2沉淀与Ca2+,注意石灰乳写成化学式,不能写成离子形式;
(3)电解熔融的氯化镁得到Mg与氯气;Mg蒸汽能与二氧化碳、氧气、氮气反应,不与氢气反应.
(2)Mg2+离子与石灰乳反应得到Mg(OH)2沉淀与Ca2+,注意石灰乳写成化学式,不能写成离子形式;
(3)电解熔融的氯化镁得到Mg与氯气;Mg蒸汽能与二氧化碳、氧气、氮气反应,不与氢气反应.
解答:解:(1)贝壳的主要成份是碳酸钙,碳酸钙在高温条件下分解生成CaO与二氧化碳,可以制备氧化钙,反应方程式为:CaCO3
CaO+CO2↑,
故答案为:CaCO3
CaO+CO2↑;
(2)Mg2+离子与石灰乳反应得到Mg(OH)2沉淀与Ca2+,石灰乳写成化学式,反应离子方程式为:Mg2++Ca(OH)2(石灰乳)═Mg(OH)2↓+Ca2+,
故答案为:Mg2++Ca(OH)2(石灰乳)═Mg(OH)2↓+Ca2+;
(3)电解熔融的氯化镁得到Mg与氯气,反应方程式为:MgCl2
Mg+Cl2↑,
Mg蒸汽能与二氧化碳、氧气、氮气反应,不与氢气反应,镁蒸汽可以在氢气氛围中冷却,
故答案为:MgCl2
Mg+Cl2↑; A.
| ||
故答案为:CaCO3
| ||
(2)Mg2+离子与石灰乳反应得到Mg(OH)2沉淀与Ca2+,石灰乳写成化学式,反应离子方程式为:Mg2++Ca(OH)2(石灰乳)═Mg(OH)2↓+Ca2+,
故答案为:Mg2++Ca(OH)2(石灰乳)═Mg(OH)2↓+Ca2+;
(3)电解熔融的氯化镁得到Mg与氯气,反应方程式为:MgCl2
| ||
Mg蒸汽能与二氧化碳、氧气、氮气反应,不与氢气反应,镁蒸汽可以在氢气氛围中冷却,
故答案为:MgCl2
| ||
点评:本题考查海水的综合利用,涉及金属制备、元素化合物性质、常用化学用语等,难度不大,(3)中注意Mg与氮气、二氧化碳的反应.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目