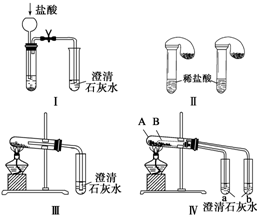
题目内容
4.如图中A到F是化合物,且A、B、E、F均含钠元素,G是地壳中含量最多的元素构成的单质气体.
(1)写出A、B、E、F的化学式:
ANaHCO3,BNa2CO3,ENa2O2,FNaOH.
(2)写出反应①②③的化学方程式:
①2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O; ②NaHCO3+NaOH═Na2CO3+H2O;③Na2CO3+CO2+H2O═2NaHCO3.
分析 G是地壳中含量最多的元素构成的单质气体,则G为O2,A、B、E、F均含钠元素,A加热分解得到B、C、D,而C、D均与E反应生成氧气,则E为Na2O2,A为NaHCO3,B为Na2CO3,C与过氧化钠反应得到碳酸钠与氧气,故C为CO2、D为H2O,则F为NaOH,据此解答.
解答 解:G是地壳中含量最多的元素构成的单质气体,则G为O2,A、B、E、F均含钠元素,A加热分解得到B、C、D,而C、D均与E反应生成氧气,则E为Na2O2,A为NaHCO3,B为Na2CO3,C与过氧化钠反应得到碳酸钠与氧气,故C为CO2、D为H2O,则F为NaOH.
(1)由上述分析可知,A为NaHCO3,B为Na2CO3,E为Na2O2,F为NaOH,
故答案为:NaHCO3;Na2CO3;Na2O2;NaOH;
(2)反应①的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
反应②的化学方程式为:NaHCO3+NaOH═Na2CO3+H2O;
反应③的化学方程式为:Na2CO3+CO2+H2O═2NaHCO3,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;NaHCO3+NaOH═Na2CO3+H2O;Na2CO3+CO2+H2O═2NaHCO3.
点评 本题考查无机物推断,涉及钠元素化合物性质语言转化,焰色反应及气体G的元素在地壳中含量为推断突破口,难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
20. 甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断不正确的是( )
甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断不正确的是( )
 甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断不正确的是( )
甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断不正确的是( )| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚>己>戊 | |
| C. | 丁的氧化物可用于制造光导纤维 | |
| D. | 常温下,甲和乙的单质均能与水剧烈反应 |
19.已知:相同的两种元素组成的四种微粒A、B、C、D的质子数依次增多,A、B、C、D的电子数如表(A、B、C、D有两组可能),且D中的电子数等于质子数,D1可作医用消毒液. 其中B1的沸点比B2高.
试回答下列问题:
(1)如表两组八种微粒的组成元素中,非金属性最强的元素在元素周期表的位置是第二周期第VI族;
(2)液态的B2与Na反应类似于B1与Na反应,写出液态的B2与Na反应的化学方程式:2Na+2NH3(l)=2NaNH2+H2↑.
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备化学反应方程式2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,其中D1的作用是还原剂.
②利用①中原理制备出NaClO2•3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与Iˉ发生反应的氧化性杂质)的纯度,过程如图(已知:I2+2S2O32ˉ═S4O62ˉ+2Iˉ):
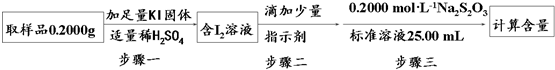
步骤一的离子方程式为ClO2-+4I-+4H+=2I2+Cl-+2H2O;步骤二的指示剂是淀粉;步骤三中出现溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点;计算该试样中NaClO2•3H2O的质量百分数为90.3%.(保留小数点后一位)
| ① | A1 | B1 | C1 | D1 |
| 电子数 | 10 | 10 | 10 | 18 |
| ② | A2 | B2 | C2 | D2 |
| 电子数 | 10 | 10 | 10 | 18 |
(1)如表两组八种微粒的组成元素中,非金属性最强的元素在元素周期表的位置是第二周期第VI族;
(2)液态的B2与Na反应类似于B1与Na反应,写出液态的B2与Na反应的化学方程式:2Na+2NH3(l)=2NaNH2+H2↑.
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备化学反应方程式2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,其中D1的作用是还原剂.
②利用①中原理制备出NaClO2•3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与Iˉ发生反应的氧化性杂质)的纯度,过程如图(已知:I2+2S2O32ˉ═S4O62ˉ+2Iˉ):

步骤一的离子方程式为ClO2-+4I-+4H+=2I2+Cl-+2H2O;步骤二的指示剂是淀粉;步骤三中出现溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点;计算该试样中NaClO2•3H2O的质量百分数为90.3%.(保留小数点后一位)
9.下列变化需要加入氧化剂才能实现的是( )
| A. | N2→NH3 | B. | MnO2→MnCl2 | C. | KI→KIO3 | D. | SO2→H2S |
16.下列溶液中H+浓度为0.1mol•L-1的是( )
| A. | 0.1 mol•L-1的CH3COOH | B. | 0.1 mol•L-1的NaHSO4 | ||
| C. | 0.1 mol•L-1的NaHCO3 | D. | 0.05 mol•L-1的H2SO3 |
13.下列现象或应用不能用胶体知识解释的是( )
| A. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 | |
| B. | 土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力 | |
| C. | 水泥、冶金厂常用高压电除去工厂烟尘,减少对空气的污染 | |
| D. | 氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体 |
14.已知:△G=△H-T△S,△H为焓变,T为热力学温度,△S熵变,当△G<0时反应能自发进行,△G>0时反应不能自发进行,据此,下列吸热反应中,在高温下不能自发进行的是( )
| A. | CO(g)═C(s)+$\frac{1}{2}$O2(g) | B. | 2N2O5(g)═4NO2(g)+O2(g) | ||
| C. | (NH4)2CO3(s)═NH4HCO3(s)+NH3(g) | D. | MgCO3(s)═MgO(s)+CO2(g) |