题目内容
1.煤的综合利用对于改善大气质量和能源充分利用有重要的意义.(1)下列说法正确的是abc(填序号).
a.煤是由有机物和少量无机物组成的复杂混合物
b.煤在燃烧过程中会生成一氧化碳、二氧化碳、氮氧化物、烟尘等有害物质
c.可利用生石灰、熟石灰、石灰石等固硫剂使煤在燃烧过程中生成稳定的硫酸盐
d.煤的干馏属于化学变化,煤的气化和液化都属于物理变化
(2)煤的气化过程中产生的有害气体H2S用氨水吸收生成正盐的离子方程式是H2S+2NH3•H2O═2NH4++S2-+2H2O.
(3)燃煤烟气的一种脱硫方案-火碱-石灰-石膏法流程图1如图:
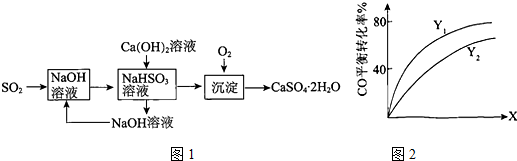
①常温下,用NaOH溶液吸收SO2得到pH=6的NaHSO3溶液,该溶液中离子浓度的大小顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
②氢氧化钙与NaHSO3反应的化学方程式是Ca(OH)2+NaHSO3═CaSO3↓+NaOH+H2O.
(4)煤的间接液化法合成二甲醚的三步反应如下:
Ⅰ.2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
Ⅱ.2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
Ⅲ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
①总反应热化学方程式:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4 kJ•mol-1
②Y(Y1、Y2),X可分别代表压强或温度.如图2表示Y一定时,总反应中CO的平衡转化率随X的变化关系.判断Y1、Y2的大小关系Y1<Y2,并简述理由:由3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)可知,压强增大,CO的平衡转化率增大,温度升高,CO的平衡转化率减小,所以X代表压强,Y代表温度,压强一定时,温度越低平衡转化率越大.
分析 (1)a.煤是由有机物和少量无机物组成的复杂的混合物;
b.从煤中含有的元素和不完全燃烧分析;
c.碳酸钙受热分解为氧化钙,二氧化硫是酸性氧化物,能与碱、碱性氧化发生反应;
d.煤的干馏、煤的气化和液化都属于化学变化;
(2)H2S用氨水吸收生成正盐硫化铵和水;
(3)①常温下,NaHSO3溶液的pH=6,NaHSO3溶液呈酸性,说明电离程度大于水解程度;
②氢氧化钙与NaHSO3反应生成沉淀亚硫酸钙、NaOH和水;
(4)①据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减;
②3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H<0,正反应气体体积减小,通过分析升高温度和增大压强导致平衡的移动方向,通过CO的平衡转化率的变化判断X、Y.
解答 解:(1)a.煤是由有机物和少量无机物组成的复杂的混合物,主要含有C元素,故a正确;
b.煤中伴有硫元素和氮元素,不完全燃烧时生成一氧化碳、二氧化硫、氮氧化物、烟尘等有害物质,故b正确;
c.碳酸钙受热分解为氧化钙,二氧化硫是酸性氧化物,能与氢氧化钙、氧化钙发生反应生成亚硫酸钙,然后被氧气氧化生成稳定的硫酸盐,故c正确;
d.煤的干馏、煤的气化和液化都属于化学变化,故d错误;
故答案为:abc;
(2)H2S用氨水吸收生成正盐硫化铵和水,离子方程式为H2S+2NH3•H2O═2NH4++S2-+2H2O;
2故答案为:H2S+2NH3•H2O═2NH4++S2-+2H2O;
(3)①常温下,NaHSO3溶液的pH=6,NaHSO3溶液呈酸性,NaHSO3溶液中存在亚硫酸氢根的水解与电离,水解导致其呈碱性,电离导致其呈酸性,据此分析:电离程度大于水解程度;故离子浓度大小为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
②氢氧化钙与NaHSO3反应生成沉淀亚硫酸钙、NaOH和水,化学方程式为Ca(OH)2+NaHSO3═CaSO3↓+NaOH+H2O,
故答案为:Ca(OH)2+NaHSO3═CaSO3↓+NaOH+H2O;
(4)①:①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律②+③+①×2得到3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-246.4 kJ•mol-1,
故答案为:-246.4 kJ•mol-1;
②3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H<0,正反应气体体积减小,升高温度,平衡逆向移动,CO的平衡转化率减小,增大压强,平衡正向移动,
CO的平衡转化率增大,因此X代表压强,Y代表温度;等压强条件下,温度越高,CO的平衡转化率越小,因此Y1<Y2,
故答案为:Y1<Y2;由3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)可知,压强增大,CO的平衡转化率增大,温度升高,CO的平衡转化率减小,所以X代表压强,Y代表温度,压强一定时,温度越低平衡转化率越大.
点评 本题考查较为综合,涉及煤的综合利用、化学(离子)方程式的书写、离子浓度的大小比较、反应热的计算和化学平衡的移动,题目难度中等,把握电离平衡、水解平衡等化学平衡及其因素为解答的关键,题目难度中等.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案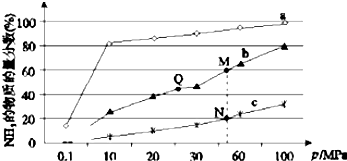
关于工业合成氨的反应,下列叙述不正确的是( )
| A. | 上图中M、N、Q点平衡常数K 的大小关系为K(M)=K(Q)>K(N) | |
| B. | 加催化剂能加快反应速率但H2的平衡转化率不变 | |
| C. | 相同压强条件下,投料相同,达到平衡所需时间关系为a>b>c | |
| D. | 由曲线a可知,当压强增加到10OMPa以上,NH3的物质的量分数可达到100% |
 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.(1)该装置中缺少的一种玻璃仪器是温度计;烧杯间填充物的作用是保温隔热,减少热量损失.
(2)实验时环形玻璃搅拌棒的运动方向是a.
a.上下运动 b.左右运动 c.顺时针运动 d.逆时针运动
(3)实验中,所用NaOH溶液稍过量的原因是保证盐酸能够完全被中和;如果用0.50mol•L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”数值将偏大(填“偏大”“偏小”或“不变”).
(4)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如下原始数据:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
(5)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①2.3℃②2.4℃③2.9℃,则最终代入计算式的温度差平均值为2.35℃.
(Ⅰ)图中三套的装置均能用于探讨化学反应中热量变化

(1)装置1适用于探究明显吸热的反应,例如2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O(用化学方程式表示),反应过程中断裂的化学键有AB(填选项)
A.离子键 B.极性共价键 C.非极性共价键
(2)装置2既适用于放热反应(或过程)的探究,也适用于吸热反应(或过程)的探究.若在装置2中完成金属铝与NaOH溶液的反应,则右侧U形管内的液面C(填选项)
A.两边一样高 B.左高右低 C.右高左低 D.高低不确定
(3)装置3可用于定量测定中和热,其中a仪器的名称为环形玻璃搅拌棒,通过实验获得如下数据,则中和热△H=-56.8kJ•mol-1(计算结果保留一位小数)
| 实验试剂及用量 | 溶液温度 | |||
| t1 | t2 | |||
| ① | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.3℃ |
| ② | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.5℃ |
| ③ | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 24.5℃ |
A.该实验中酸碱的浓度不宜太大也不宜太小
B.可以用铜丝代替a仪器
C.量取酸溶液时视线俯视,将使测得的中和热的数值偏高
D.其他条件不变,将酸溶液体积调整为40ml,将使测得的中和热的数值偏高
E.向盛装酸的烧杯中加碱时要小心缓慢
F.测了酸后的温度计要用水清洗后再测碱的温度.
| A. | 都能电离出氢离子 | B. | 都能使石蕊试液变红 | ||
| C. | 都能跟碱反应生成盐和水 | D. | 都含有氧元素 |
NaBr+H2SO4═HBr+NaHSO4
CH3CH2CH2CH2OH+HBr $\stackrel{△}{→}$ CH3CH2CH2CH2Br+H2O
在圆底烧瓶中加入原料,充分振荡后加入几粒沸石,安装装置Ⅰ.加热至沸腾,反应约40min.待反应液冷却后,改装为装置Ⅱ,蒸出粗产品.部分物理性质列表如下:

| 物质 | 正丁醇 | 正溴丁烷 |
| 沸点/℃ | 117.2 | 101.6 |
| 熔点/℃ | -89.12 | -112.4 |
| 密度/g•cm-3 | 0.8098 | 1.2758 |
| 溶解性 | 微溶于水,溶于浓硫酸 | 不溶于水和浓硫酸 |
回答下列问题:
(1)仪器A的名称是球形冷凝管,冷却水从A的下(填“上”或“下”)口通入.
(2)在圆底烧瓶中加入的原料有:①10ml水;②7.5ml正丁醇;③10g溴化钠;④12mL浓硫酸.上述物质的加入顺序合理的是a(填正确答案标号).
a.①④②③b.④①②③c.③④①②
(3)烧杯B中盛有NaOH溶液,吸收的尾气主要是HBr(填化学式).本实验使用电热套进行加热,总共使用了3次.
(4)用浓硫酸洗涤粗产品时,有机层从分液漏斗上口倒出(填“上口倒出”或“下口放出”).最后一次水洗主要是洗掉有机物中少量的碳酸氢钠.
(5)制备正溴丁烷时,不直接用装置Ⅱ边反应边蒸出产物,其原因是正丁醇、正溴丁烷的沸点相差较小,若边反应边蒸馏,会有较多的正丁醇被蒸出,使产率降低.
(6)本实验得到正溴丁烷6.5g,产率为$\frac{6.5×74}{7.5×0.8098×137}$×100%(只列式,不必计算出结果).
| A. | 乙烷和氯气取代反应 | B. | 乙烯和氯气加成反应 | ||
| C. | 乙烯和HCl加成反应 | D. | 乙烷和HCl作用 |
 +NaOH→
+NaOH→ +
+


 .
.