题目内容
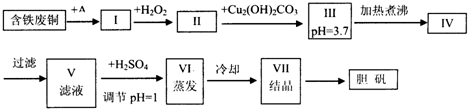
利用天然气合成氨的部分工艺流程图如下:
依据上述流程,完成下列问题:
(1)写出流程中一次转化的化学方程式: .
(2)上述流程有二处循环,一是K2CO3(aq)循环,二是 循环(填化学式).
(3)1998年科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解法合成氨.写出阳极反应式: .
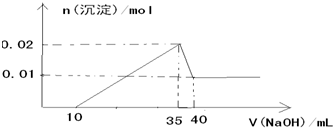
(4)一定条件下,将a mol N2与b mol H2的混合气体通入容积为2L的密闭容器中,发生反应:
N2(g)+
H2(g)?NH3(g)△H<0.达到平衡时,测得n(N2)=13mol;n(NH3)=6mol
①该反应平衡常数的表达式:K= ;
②达到平衡时
的转化率为 ;
③为了提高H2的转化率,可采取的措施是 (填写字母编号).
A.增大H2的浓度 B.增大N2的浓度 C.使用催化剂 D.降低温度.

依据上述流程,完成下列问题:
(1)写出流程中一次转化的化学方程式:
(2)上述流程有二处循环,一是K2CO3(aq)循环,二是
(3)1998年科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解法合成氨.写出阳极反应式:
(4)一定条件下,将a mol N2与b mol H2的混合气体通入容积为2L的密闭容器中,发生反应:
| 1 |
| 2 |
| 3 |
| 2 |
①该反应平衡常数的表达式:K=
②达到平衡时
| N | 2 |
③为了提高H2的转化率,可采取的措施是
A.增大H2的浓度 B.增大N2的浓度 C.使用催化剂 D.降低温度.
考点:工业合成氨,化学平衡的影响因素
专题:化学平衡专题
分析:(1)依据流程图中给出的物质写出化学方程式即可;
(2)依据流程图中得出多次用到N2、H2据此解答即可;
(3)阳极失去电子,化合价升高,据此解答即可;
(4)依据化学反应方程式写出平衡常数表达式,依据平衡移动原理计算转化率以及采取的措施.
(2)依据流程图中得出多次用到N2、H2据此解答即可;
(3)阳极失去电子,化合价升高,据此解答即可;
(4)依据化学反应方程式写出平衡常数表达式,依据平衡移动原理计算转化率以及采取的措施.
解答:
解:(1)一次转化中产物为一氧化碳和氢气,故答案为:CH4+H2O=CO+3H2;
(2)上述流程有二处循环,一是K2CO3(aq)循环,二是氮气和氢气循环,故答案为N2、H2;
(3)阳极为失去电子的反应,发生氧化反应,化合价升高,那么就是氢气反应,故答案为:H2-2e-=2H+;
(4)①依据反应方程式的出会心反应平衡常数表达式为:K=
,故答案为:K=
;
②依据
N2+
H2?NH3(g)
始态 a b 0
转化 x 6
平衡 13 6
可以计算转化x=3,故a=13+3=16,故转化率为
×100%=18.75%,故答案为18.75%;
③增大一种反应物的浓度,可以提高另一种反应物的转化率;平衡右移可以增加反应物的转化率,故答案为BD.
(2)上述流程有二处循环,一是K2CO3(aq)循环,二是氮气和氢气循环,故答案为N2、H2;
(3)阳极为失去电子的反应,发生氧化反应,化合价升高,那么就是氢气反应,故答案为:H2-2e-=2H+;
(4)①依据反应方程式的出会心反应平衡常数表达式为:K=
| c(NH3) | ||||
c
|
| c(NH3) | ||||
c
|
②依据
| 1 |
| 2 |
| 3 |
| 2 |
始态 a b 0
转化 x 6
平衡 13 6
可以计算转化x=3,故a=13+3=16,故转化率为
| 3 |
| 13 |
③增大一种反应物的浓度,可以提高另一种反应物的转化率;平衡右移可以增加反应物的转化率,故答案为BD.
点评:本题主要考查化学平衡计算、电化学等,难度中等,旨在考查学生对知识的掌握与运用,加强基础知识的掌握理解.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
把4g NaOH固体溶于水,配成1L 溶液,溶液中NaOH的物质的量浓度是( )
| A、2 mol/L |
| B、0.2 mol/L |
| C、1 mol/L |
| D、0.1mol/L |
下列各图中哪一个是氧原子的电子排布图( )
A、 |
B、 |
C、 |
D、 |
设NA为阿伏加德罗常数,下列叙述正确的是( )
| A、24 g镁的原子最外层电子数为NA |
| B、1 L 0.1 mol?L-1硫酸溶液中H+数为0.1NA |
| C、1 mol甲烷分子所含质子数为10NA |
| D、标准状况下,22.4 L乙醇的分子数为NA |

 利用如图装置验证同主族元素非金属性的变化规律.
利用如图装置验证同主族元素非金属性的变化规律.