题目内容
胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料,现有废铜(主要杂质为Fe)来制备胆矾.有人设计了如下流程:
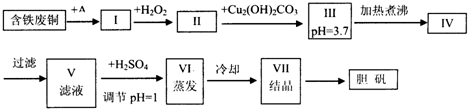
pH值控制可参考下列数据
请根据上述流程回答下列问题:
(1)A可选用 (填字母)
a.稀H2SO4 b.浓H2SO4、加热 c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的 .
(3)Ⅱ中加Cu2(OH)2CO3的目的是 ,其优点是 .
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为 .
(5)V中加H2SO4调节pH=1是为了 ,某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是 ,若你是工程师,将对所加的A物质作何改进?请提出建议 .

pH值控制可参考下列数据
| 物质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
(1)A可选用
a.稀H2SO4 b.浓H2SO4、加热 c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的
(3)Ⅱ中加Cu2(OH)2CO3的目的是
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为
(5)V中加H2SO4调节pH=1是为了
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:废铜(主要杂质为Fe)来制备胆矾的流程:将金属全部溶解,再将存在的亚铁离子氧化为铁离子,再结合Cu2+开始沉淀时的pH值,Fe转化为Fe(OH)3更容易除去.加入H2O2,目的是将二价铁转化为三价铁,在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,目的应是调节溶液的酸碱性,所以这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7,刚好此时溶液中三价铁正全转化为Fe(OH)3.当三价铁沉淀完全后,再进行过滤,滤液中剩余的阳离子主要有Cu2+,阴离子有SO42-,再加硫酸,调节溶液pH值=1,目的是抑制Cu2+的水解,再分别进行蒸发、冷却、结晶后,最终得到产品胆矾.
解答:
解:废铜(主要杂质为Fe)来制备胆矾的流程:将金属全部溶解,再将存在的亚铁离子氧化为铁离子,再结合Cu2+开始沉淀时的pH值,可以Fe最终转化为Fe(OH)3更容易除去,保证铜离子不会沉淀,不能引进杂质离子,加入H2O2,目的是将二价铁转化为三价铁,在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,目的应是调节溶液的酸碱性,所以这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7,刚好此时溶液中三价铁正全转化为Fe(OH)3.当三价铁沉淀完全后,再进行过滤,滤液中剩余的阳离子主要有Cu2+,阴离子有SO42-,再加硫酸,调节溶液pH值=1,目的是抑制Cu2+的水解,再分别进行蒸发、冷却、结晶后,最终得到产品胆矾.
(1)A可选用浓H2SO4、加热,稀硫酸不能溶解Cu,而浓FeCl3溶液、浓HNO3会引入杂质,故答案为:b;
(2)H2O2与Fe2+发生氧化还原反应,Fe2+被氧化为Fe3+后,调节pH,更容易除去,所以Ⅰ中加H2O2的目的将亚铁离子氧化为铁离子,故答案为:将Fe2+氧化为Fe3+;
(3)在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7,刚好此时溶液中三价铁正全转化为Fe(OH)3,并且不引入新的杂质,故答案为:除去过量的硫酸;不引入新的杂质;
(4)Ⅲ加热煮沸时,促进铁离子水解,可以得到氢氧化铁沉淀,发生的化学反应的离子方程式为:Fe3++3H2O
Fe(OH)3↓+3H+,故答案为:Fe3++3H2O
Fe(OH)3↓+3H+;
(5)V中加H2SO4调节pH=1是为了抑制Cu2+的水解,但是Cu与浓硫酸反应过程中会产生SO2,会对污染环境,这样会使硫酸的利用率低,所以可以向稀硫酸中不断通氧气(或者加H2O2)并加热,故答案为:抑制Cu2+的水解;会产生SO2,会对污染环境,硫酸的利用率低;可以向稀硫酸中不断通氧气(或者加H2O2)并加热.
(1)A可选用浓H2SO4、加热,稀硫酸不能溶解Cu,而浓FeCl3溶液、浓HNO3会引入杂质,故答案为:b;
(2)H2O2与Fe2+发生氧化还原反应,Fe2+被氧化为Fe3+后,调节pH,更容易除去,所以Ⅰ中加H2O2的目的将亚铁离子氧化为铁离子,故答案为:将Fe2+氧化为Fe3+;
(3)在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7,刚好此时溶液中三价铁正全转化为Fe(OH)3,并且不引入新的杂质,故答案为:除去过量的硫酸;不引入新的杂质;
(4)Ⅲ加热煮沸时,促进铁离子水解,可以得到氢氧化铁沉淀,发生的化学反应的离子方程式为:Fe3++3H2O
| ||
| ||
(5)V中加H2SO4调节pH=1是为了抑制Cu2+的水解,但是Cu与浓硫酸反应过程中会产生SO2,会对污染环境,这样会使硫酸的利用率低,所以可以向稀硫酸中不断通氧气(或者加H2O2)并加热,故答案为:抑制Cu2+的水解;会产生SO2,会对污染环境,硫酸的利用率低;可以向稀硫酸中不断通氧气(或者加H2O2)并加热.
点评:本题是一道实验方案的设计题,考查学生物质的制备、除杂等方面的综合知识,注意知识的灵活应用是关键,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:下列判断不正确的是( )
| 实验编号 | c(HA)/mo1?L-1 | c(NaOH)/mo1?L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | PH=9 |
| 乙 | c1 | 0.2 | PH=7 |
| A、甲反应后的溶液中:c(HA)+c(A-)=0.05mo1?L-1 |
| B、c1一定大于0.2 mo1?L-1 |
| C、0.1 mo1?L-1的HA溶液中由水电离出的c(H+)=1×l0-13mo1/L |
| D、乙反应后的溶液中:c(Na+)<c(HA)+c(A-) |
下列各分子中所有原子都满足最外层为8电子结构的是( )
| A、HClO |
| B、NO2 |
| C、BeCl2 |
| D、CO2 |
 【选做题--物质结构与性质】
【选做题--物质结构与性质】
 铝是地壳中含量最高的金属元素,在所有的元素中位居第三位.
铝是地壳中含量最高的金属元素,在所有的元素中位居第三位.