题目内容
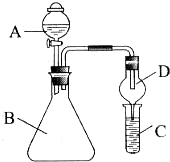 利用如图装置验证同主族元素非金属性的变化规律.
利用如图装置验证同主族元素非金属性的变化规律.(1)若要证明非金属性:Cl>I,A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾溶液,观察到C溶液中的现象是
(2)若要证明非金属性:C>Si,则在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,观察到C中溶液的现象是
考点:性质实验方案的设计
专题:实验设计题
分析:(1)氯气具有强氧化性,能将碘离子氧化为碘单质,碘遇淀粉试液变蓝色;氯气有毒,不能直接排空,但能和碱溶液反应生成盐;
(2)二氧化碳和硅酸钠反应生成难溶性的硅酸;氯化氢具有挥发性,导致生成的二氧化碳中含有HCl,从而造成干扰,可以用饱和的碳酸氢钠溶液吸收HCl.
(2)二氧化碳和硅酸钠反应生成难溶性的硅酸;氯化氢具有挥发性,导致生成的二氧化碳中含有HCl,从而造成干扰,可以用饱和的碳酸氢钠溶液吸收HCl.
解答:
解:(1)KMnO4与浓盐酸反应生成氯气,氯气与淀粉碘化钾混合溶液反应生成碘单质,碘遇淀粉试液变蓝色,氯气作氧化剂、碘是氧化产物,所以氧化性:氯气>碘;过量的氯气会逸散到空气中,污染环境,可用碱液吸收,
故答案为:无色溶液变蓝;NaOH;
(2)碳酸和硅酸钠反应生成硅酸沉淀和碳酸钠,所以C中有白色沉淀生成;碳酸钙和盐酸反应是放热反应,放出的热量促进氯化氢挥发,导致制取的二氧化碳中含有HCl,HCl和硅酸钠反应生成硅酸,从而对二氧化碳产生干扰,为防止干扰,用饱和的碳酸氢钠溶液除去HCl,所以应在两装置间添加装有饱和NaHCO3溶液的洗气瓶除去,
故答案为:有白色沉淀生成;饱和NaHCO3.
故答案为:无色溶液变蓝;NaOH;
(2)碳酸和硅酸钠反应生成硅酸沉淀和碳酸钠,所以C中有白色沉淀生成;碳酸钙和盐酸反应是放热反应,放出的热量促进氯化氢挥发,导致制取的二氧化碳中含有HCl,HCl和硅酸钠反应生成硅酸,从而对二氧化碳产生干扰,为防止干扰,用饱和的碳酸氢钠溶液除去HCl,所以应在两装置间添加装有饱和NaHCO3溶液的洗气瓶除去,
故答案为:有白色沉淀生成;饱和NaHCO3.
点评:本题考查了实验方案设计,涉及金属、非金属性强弱的探究,明确物质的性质是解本题关键,同时考查学生灵活运用知识解答问题的能力,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、摩尔是物质的数量单位,含有6.02×1023个微粒的物质叫做1摩尔 |
| B、1mol氧含有6.02×1023个氧原子 |
| C、在标准状况下,任何物质的摩尔体积约为22.4L/mol |
| D、一定质量的气体的体积随压强增大和温度降低而变小 |
常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:下列判断不正确的是( )
| 实验编号 | c(HA)/mo1?L-1 | c(NaOH)/mo1?L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | PH=9 |
| 乙 | c1 | 0.2 | PH=7 |
| A、甲反应后的溶液中:c(HA)+c(A-)=0.05mo1?L-1 |
| B、c1一定大于0.2 mo1?L-1 |
| C、0.1 mo1?L-1的HA溶液中由水电离出的c(H+)=1×l0-13mo1/L |
| D、乙反应后的溶液中:c(Na+)<c(HA)+c(A-) |

 铝是地壳中含量最高的金属元素,在所有的元素中位居第三位.
铝是地壳中含量最高的金属元素,在所有的元素中位居第三位.




