题目内容
5.下列描述中正确的是( )| A. | 已知:P4(白磷,s)═4P(红磷,s),△H<0,则白磷比红磷稳定 | |
| B. | 由S (s)+O2(g)═SO2(g) (g)△H=-296.8 kJ•mol-1可知硫的标准燃烧热为296.8 kJ•mol-1 | |
| C. | OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ•mol-1,故1 mol醋酸与1 mol NaOH完全反应,放出的热量为57.3 kJ•mol-1 | |
| D. | 甲醇燃料电池中,通入甲醇的一极为负极 |
分析 A.物质具有的能量越低,越稳定;
B.标准燃烧热是在标准状况下测定的数据;
C.醋酸电离吸热;
D.原电池中失电子的一极为负极.
解答 解:A.已知:P4(白磷,s)═4P(红磷,s),△H<0,白磷的能量比红磷高,则红磷比白磷稳定,故A错误;
B.标准燃烧热是在标准状况下测定的数据,热化学方程式中的反应热的数据一般是在25℃条件下测定的,所以硫的标准燃烧热不是296.8 kJ•mol-1,故B错误;
C.OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ•mol-1,由于醋酸电离吸热,则1 mol醋酸与1 mol NaOH完全反应,放出的热量小于57.3 kJ,故C错误;
D.原电池中失电子的一极为负极,甲醇燃料电池中,甲醇失电子,所以通入甲醇的一极为负极,故D正确.
故选D.
点评 本题考查了化学反应与能量变化、原电池原理的应用,题目难度不大,侧重于考查学生对基础知识的应用能力,注意把握物质稳定性与能量的关系以及原电池中电极的判断.

练习册系列答案
相关题目
15.如图是一种酸性燃料电池酒精检测仪,具有自动吹气流量监测与控制的功能,下列有关说法正确的是( )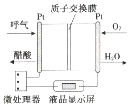

| A. | 电流由呼气所在的铂电极流出 | |
| B. | H+透过质子交换膜流向氧气所在的铂电极 | |
| C. | 电路中流过2mol电子时,消耗11.2LO2 | |
| D. | 该电池的负极反应为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ |
12.下列实验方案中,能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| ① | 检验淀粉是否水解生成葡萄糖 | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后新制Cu(OH)2浊液,加热,观察是否有红色沉淀生成 |
| ② | 比较H2CO3,HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液的pH,比较pH大小 |
| ③ | 区别植物油和矿物油 | 向植物油和矿物油中分别加入烧碱溶液,加热,冷却后观察是否分层 |
| ④ | 验证CaCO3的溶解度小于CaSO4 | 将浓Na2CO3溶液滴加到CaSO4悬浊液中,充分振荡,过滤、洗涤,向所得固体中滴加盐酸,观察是否有气体生成 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①③ |
10.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+.取该溶液100mL,加入过量NaOH,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到l.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
| A. | 至少存在5种离子 | |
| B. | C1-一定存在,且c Cl-)≥0.4mol/L | |
| C. | SO42-、NH4+一定存在,CO32-可能存在 | |
| D. | CO32-、Al3+一定不存在,K+一定存在 |