题目内容
某同学欲设计下列实验探究某些非金属元素及其化合物的性质,其中能达到目的是( )
| A、测定相同浓度HX(X=F、Cl、Br、I)溶液的pH比较卤族元素的非金属性 |
| B、将胆矾(CuSO4?5H2O)晶体放入浓硫酸中:验证浓硫酸的脱水性 |
| C、将CO2通入水玻璃中:比较碳酸与硅酸的酸性强弱 |
| D、将铁片放入热的浓硝酸中:验证铁在浓硝酸中发生钝化 |
考点:化学实验方案的评价
专题:
分析:A.元素的非金属性与其气态氢化物水溶液的酸碱性无关;
B.胆矾(CuSO4?5H2O)晶体放入浓硫酸,胆矾失去结晶水;
C.CO2通入水玻璃中,生成硅酸,发生强酸制取弱酸的反应;
D.铁片放入热的浓硝酸中,发生氧化还原反应.
B.胆矾(CuSO4?5H2O)晶体放入浓硫酸,胆矾失去结晶水;
C.CO2通入水玻璃中,生成硅酸,发生强酸制取弱酸的反应;
D.铁片放入热的浓硝酸中,发生氧化还原反应.
解答:
解:A.元素的非金属性与其气态氢化物水溶液的酸碱性无关,但同主族可比较,则测定相同浓度HX(X=F、Cl、Br、I)溶液的pH,pH小的对应卤族元素的非金属性强,故A正确;
B.将胆矾晶体放入浓硫酸中,固体变白,可证明浓硫酸的吸水性,故B错误;
C.将CO2通入水玻璃中生成白色沉淀,根据复分解反应中强酸制备弱酸的原理,碳酸酸性大于硅酸的酸性,故C正确;
D.铁只有在冷的浓硝酸中才能发生钝化,故D错误;
故选AC.
B.将胆矾晶体放入浓硫酸中,固体变白,可证明浓硫酸的吸水性,故B错误;
C.将CO2通入水玻璃中生成白色沉淀,根据复分解反应中强酸制备弱酸的原理,碳酸酸性大于硅酸的酸性,故C正确;
D.铁只有在冷的浓硝酸中才能发生钝化,故D错误;
故选AC.
点评:本题考查化学实验方案的评价,为高频考点,把握非金属性比较、物质的性质及反应原理等为解答的关键,侧重反应原理及性质应用能力的考查,选项A为解答的难点,题目难度不大.

练习册系列答案
相关题目
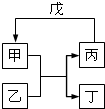 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图5所示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图5所示转化关系的是( )| 甲 | 乙 | 丙 | 戊 | |
| ① | NH3 | O2 | NO2 | H2 |
| ② | Fe | H2O | Fe3O4 | Al |
| ③ | Al2O3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
| A、①③ | B、②③ | C、②④ | D、①④ |
下列说法中正确的是( )
| A、近期媒体报道的某白酒中的增塑剂是对人体健康无害的物质 |
| B、尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”的宗旨 |
| C、垃圾是放错地方的资源,应分类回收利用 |
| D、光化学烟雾、酸雨等可能与PM2.5的存在有关 |
已知25℃时三种金属硫化物的溶度积常数分别是:KSP(FeS)=6.3×10-18 mol2?L-2、KSP(CuS)=1.3×10-36 mol2?L-2、KSP(MnS)=2.5×10-13mol2?L-2,下列说法中正确的是( )
| A、25℃时,FeS的溶解度大于MnS的溶解度 |
| B、25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol?L-1 |
| C、除去某溶液中的Cu2+,可以选用FeS或MnS作沉淀剂 |
| D、因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生 |
下列实验操作与安全事故处理正确的是( )
| A、实验剩余的钠可放入废液缸中 |
| B、用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 |
| C、大量氯气泄漏时,迅速离开现场,并逆风前往安全区域疏散 |
| D、不慎洒出的酒精在桌上着火时,立即用大量水扑灭 |
下列说法不符合人与自然和谐相处的是( )
| A、用电动汽车代替燃油汽车 |
| B、将聚乙烯等塑料垃圾深埋或倾入海中 |
| C、用沼气、太阳能、风能等能源替代化石燃料 |
| D、大力实施矿物燃料的脱硫脱硝技术以减少SO2、NOx的排放 |