题目内容
9.由以下粒子结构示意图得出的结论正确的是( )
| A. | ④表示的是阳离子 | |
| B. | ?①③属于同种元素,?②④属于另一种元素 | |
| C. | ?②④形成的化合物是Al2O3 | |
| D. | ①③的化学性质相似 |
分析 A、当质子数>核外电子数,为阳离子,进行分析判断;
B、元素是质子数(即核电荷数)相同的一类原子的总称,同种元素的粒子是质子数相同,进行分析判断;
C、根据②、④的核内质子数分别是16、13,分别为硫元素、铝元素;
D、决定元素化学性质的是原子的最外层电子数.
解答 解:A、④质子数=13,核外电子数=10,质子数>核外电子数,为阳离子,故A正确;
B、元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),同种元素的粒子是质子数相同,①③的质子数相同,属于同种元素;②、④的核内质子数分别是16、13,属于另外两种元素,故B错误;
C、②、④的核内质子数分别是16、13,分别为硫元素、铝元素;硫原子的最外层电子数为6,在化学反应中易得到2个电子而形成2个单位负电荷的阴离子,化合价的数值等于离子所带电荷的数值,且符号一致,则该元素的化合价为-2价;④是带3个单位正电荷的阳离子,化合价的数值等于离子所带电荷的数值,且符号一致,则该元素的化合价为+3价;铝元素显+3价,硫元素显-2价,镁和氯组成化合物的化学式为Al2S3,故C错误;
D、决定元素化学性质的是原子的最外层电子数,①③的最外层电子数不同,化学性质不相似,故D错误;
故选A.
点评 本题难度不大,考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.

练习册系列答案
相关题目
19.对于碳原子数小于或等于 6 的烃,下列说法中正确的是( )
| A. | C2H4 的结构简式可表示为 CH2CH2 | |
| B. | 6 个碳原子形成的烃分子中,最多有5个C-C单键 | |
| C. | C6H6 分子中,所有原子均可能在同一平面内 | |
| D. | C3H6 分子中一定含有 |
20.当运动员肌肉挫伤时.队医随即对准运动员的受伤部位喷射药剂氯乙烷(化学式为C2H5Cl,沸点为12.3℃),进行局部冷冻麻醉处理.下列关于氯乙烷的说法错误的是( )
| A. | 氯乙烷是由碳、氢、氯三种元素组成的化合物 | |
| B. | 氯乙烷是由2个碳原子、5个氢原子和1个氯原子构成的 | |
| C. | 氯乙烷用于冷冻麻醉与其沸点较低,易挥发吸热有关 | |
| D. | 氯乙烷中碳、氢、氯三种元素的质量比为48:10:7l |
17. 某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到导管中甲处液面下降,乙处液面上升.关于该反应的叙述正确的是( )
某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到导管中甲处液面下降,乙处液面上升.关于该反应的叙述正确的是( )
①该反应为放热反应
②生成物的总能量比反应物的总能量高
③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来.
 某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到导管中甲处液面下降,乙处液面上升.关于该反应的叙述正确的是( )
某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到导管中甲处液面下降,乙处液面上升.关于该反应的叙述正确的是( ) ①该反应为放热反应
②生成物的总能量比反应物的总能量高
③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来.
| A. | ①②③ | B. | ①③ | C. | ①② | D. | ② |
14.面对日益严重的资源短缺及环境污染问题,“变废为宝”成为化学发展的新方向.废旧酸性锌锰干电池经分离破碎后的锰粉含Mn02、Mn0(0H)、Zn(NH3)CL2、Fe、NH4C1和炭黑等,可用于制取Mn02高性能磁性材料MnC03,其工艺流程如下:
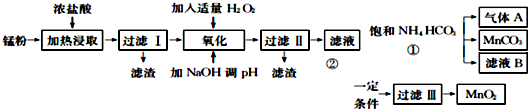
已知几种氢氧化物开始沉淀和完全沉淀的pH如表:
回答下列问题:
(1)过滤工得到的滤渣主要成分是碳黑.
(2)滤液经氧化后加入NaOH溶液调节pH至8.5〜8.8,其目的是除去Fe3+、Zn2+.
(3)过滤Ⅱ得到的滤液中含有的阳离子主要是Mn2+、NH4+、Na+(填离子符号).
(4)过程①中发生反应的离子方程式为Mn2++2HCO3-=MnCO3+CO2↑+H2O,对气体A和滤液B应采取的处理方法分别是CO2循环利用,用于生产NH4HCO3;滤液B中含有NH4Cl,可分离用作氮肥.
(5)过程②得到MnO2.将MnO2成悬浊液,通S02还原可得MnSO4,再加入Na2CO3或NaHCO3,也可制备MnCO3.SO2还原MnO2的化学方程式为MnO2+S02=MnSO4,向MnS04溶液中加入Na2C03或NaHC03制备MnC03时应注意的问题是边搅拌边加入Na2C03或NaHC03,并控制溶液的pH<8.8.

已知几种氢氧化物开始沉淀和完全沉淀的pH如表:
| 氢氧化物 | Fe(OH) | Fe(OH) | Mn0H)2 | Zn(OH)2 |
| 开始沉淀的pH | 7.5 | 2.2 | 8.8 | 6.4 |
| 沉淀完全的pH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤工得到的滤渣主要成分是碳黑.
(2)滤液经氧化后加入NaOH溶液调节pH至8.5〜8.8,其目的是除去Fe3+、Zn2+.
(3)过滤Ⅱ得到的滤液中含有的阳离子主要是Mn2+、NH4+、Na+(填离子符号).
(4)过程①中发生反应的离子方程式为Mn2++2HCO3-=MnCO3+CO2↑+H2O,对气体A和滤液B应采取的处理方法分别是CO2循环利用,用于生产NH4HCO3;滤液B中含有NH4Cl,可分离用作氮肥.
(5)过程②得到MnO2.将MnO2成悬浊液,通S02还原可得MnSO4,再加入Na2CO3或NaHCO3,也可制备MnCO3.SO2还原MnO2的化学方程式为MnO2+S02=MnSO4,向MnS04溶液中加入Na2C03或NaHC03制备MnC03时应注意的问题是边搅拌边加入Na2C03或NaHC03,并控制溶液的pH<8.8.
1.已知0.25molX气体的质量为8g,则X气体的摩尔质量是( )
| A. | 16g | B. | 32g | C. | 64g/mol | D. | 32g/mol |