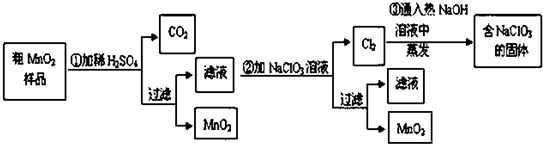
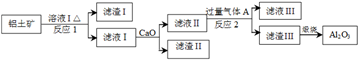
题目内容
向0.1mol/L的CH3COOH溶液中,加入下列物质,引起醋酸的电离程度和溶液的pH变化是(填增大、减小、不变).
A.H2O ;
B.CH3COONa ;
C.NH3?H2O ;
D.H2SO4 ;
E.加热 ;
F.加少量冰醋酸 .
A.H2O
B.CH3COONa
C.NH3?H2O
D.H2SO4
E.加热
F.加少量冰醋酸
考点:弱电解质在水溶液中的电离平衡
专题:
分析:含有与醋酸电离出相同离子的物质能抑制醋酸电离,能使醋酸的电离程度变小,则应该加入含有氢离子或醋酸根离子的物质;要使溶液的pH变小,则溶液中氢离子浓度增大,则加入的物质中含有氢离子或升高温度,两个条件结合分析解答.
解答:
解:A.向醋酸中加入少量水,促进醋酸电离,则醋酸的电离程度增大,但是氢离子浓度减小,所以pH增大,故答案为:增大;增大;
B.向醋酸中加入醋酸钠固体,醋酸钠溶于水电离出醋酸根离子,抑制醋酸电离,醋酸的电离程度减小,且溶液的pH增大,故答案为:减小;增大;
C.向醋酸中加入氨水,氨水和氢离子反应,促进醋酸电离,且溶液的pH增大,故答案为:增大;增大;
D.向醋酸溶液中加入硫酸,氢离子浓度增大,溶液的pH减小,同时抑制醋酸电离,醋酸的电离程度减小,故答案为:减小;减小;
E.加热促进醋酸电离,且氢离子浓度增大,溶液的pH减小,故答案为:增大;减小;
F.加少量冰醋酸,浓度越大越不易电离,所以电离程度减小,但是氢离子浓度增大,所以pH减小,故答案为:减小;减小.
B.向醋酸中加入醋酸钠固体,醋酸钠溶于水电离出醋酸根离子,抑制醋酸电离,醋酸的电离程度减小,且溶液的pH增大,故答案为:减小;增大;
C.向醋酸中加入氨水,氨水和氢离子反应,促进醋酸电离,且溶液的pH增大,故答案为:增大;增大;
D.向醋酸溶液中加入硫酸,氢离子浓度增大,溶液的pH减小,同时抑制醋酸电离,醋酸的电离程度减小,故答案为:减小;减小;
E.加热促进醋酸电离,且氢离子浓度增大,溶液的pH减小,故答案为:增大;减小;
F.加少量冰醋酸,浓度越大越不易电离,所以电离程度减小,但是氢离子浓度增大,所以pH减小,故答案为:减小;减小.
点评:本题考查了影响弱电解质电离的因素,难度不大,注意:如果加入含有相同离子的物质就抑制其电离,如果加入和弱电解质电离的离子发生反应的物质就促进其电离.

练习册系列答案
相关题目
以下各组离子在该溶液中能大量共存的有( )
| A、滴加石蕊试液显红色的溶液:Fe3+、NH4+、CO32-、I- |
| B、pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- |
| C、水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Cl-、Ba2+ |
| D、所含溶质为Na2CO3的溶液:K+、Na+、NO3-、Al3+ |
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
| A、H2O2+H2SO4=SO2↑+O2↑+2H2O |
| B、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| C、SO2+I2+2H2O=H2SO4+2HI |
| D、Cl2+SO2+2H2O=H2SO4+2HCl |
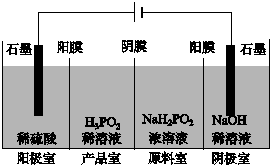 次磷酸(H3PO2)也是一种中强酸,具有强还原性,与足量NaOH反应生成NaH2PO2.H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
次磷酸(H3PO2)也是一种中强酸,具有强还原性,与足量NaOH反应生成NaH2PO2.H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):