题目内容
7.下列反应中,既属于氧化还原反应又属于离子反应的是( )| A. | 碳酸钠与盐酸反应 | B. | 氧化铁与一氧化碳在高温下反应 | ||
| C. | 氧化铜与硫酸反应 | D. | 铁粉与硫酸铜溶液反应 |
分析 有离子参加的反应为离子反应,反应中存在元素的化合价变化,为氧化还原反应,以此来解答.
解答 解:A.不存在元素的化合价变化,不属于氧化还原反应,故A错误;
B.Fe、C元素的化合价变化,为氧化还原反应,但不属于离子反应,故B错误;
C.不存在元素的化合价变化,不属于氧化还原反应,故C错误;
D.有离子反应,且Fe、H元素的化合价变化,既属于离子反应又属于氧化还原反应,故D正确.
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意是否有离子参加反应及元素化合价判断,题目难度不大.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
18.下列有关惰性电极电解AgNO3溶液一段时间后的说法,正确的是( )
| A. | 电解过程中阴极质量不变 | |
| B. | 电解过程中溶液的pH不断升高 | |
| C. | 此时向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况 | |
| D. | 电解后两极产生的气体体积比为2:1 |
15.下列叙述正确的是( )
| A. | 0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (Na+)>c (CN-)>c (HCN)>c (OH-)>c (H+) | |
| B. | 20 mL 0.1 mol/L的Na2CO3溶液与等体积等浓度的盐酸混合充分反应后的溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)=2c(Cl-)=0.1 mol/L | |
| C. | 浓度均为1 mol/L的以下溶液:①醋酸 ②NaOH溶液 ③盐酸 ④醋酸钠溶液,其水的电离程度的关系为:④>①>③>② | |
| D. | 相同温度下,pH值相同的CH3COONa溶液与NaHCO3溶液一定存在关系:c(CH3COO-)=c(HCO3-)+2c(CO32-) |
2.下列叙述正确的是( )
| A. | 用加热法除去NaOH固体中混有的NH4Cl固体. | |
| B. | 向Al2(SO4)3溶液中滴加过量的NaOH溶液制备Al(OH)3 | |
| C. | SO2能使酸性KMnO4溶液褪色,说明SO2具有漂白性 | |
| D. | 向水玻璃中滴加盐酸制备硅酸 |
12.下列离子方程式中,不正确的是( )
| A. | 向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
19.水的摩尔质量和1mol水的质量分别是( )
| A. | 18,18 | B. | 18g,18g | C. | 18g/mol,18g | D. | 18g,18g/mol |
16.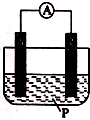 如图所示装置中,可观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )
如图所示装置中,可观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )
 如图所示装置中,可观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )
如图所示装置中,可观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )| 选项 | M | N | P |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 锌 | 稀盐酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |
| A. | A | B. | B | C. | C | D. | D |
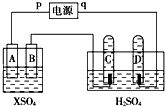 如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡,试回答:
如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡,试回答: