题目内容
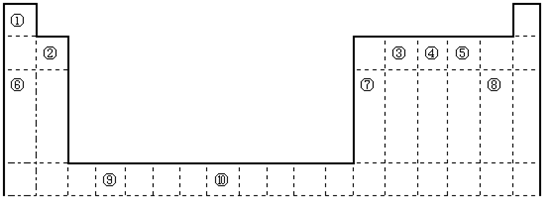
 如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )
如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )分析:设X的原子序数为x,根据四种元素在周期表中的位置可知,Z的原子序数为x+7,则x+x+7=21,x=7,所以X为N元素,Z为Si元素,Y为F元素,W为S元素,根据元素所在周期表中的位置,结合原子的结构、元素的性质和元素周期律的递变规律解答该题.
解答:解:设X的原子序数为x,根据四种元素在周期表中的位置可知,Z的原子序数为x+7,则x+x+7=21,x=7,所以X为N元素,Z为Si元素,Y为F元素,W为S元素,
A、W为S元素,所形成的单质为分子晶体,故A错误;
B、X与Y在同一周期,同一周期从左到右元素的非金属性逐渐增强,则Y的非金属性较强,故B错误;
C、X为N元素,Z为Si元素,以共价键结合形成一种无机非金属材料Si3N4,故C正确;
D、Y为F元素,没有正价,最高化合价为0,不存在含氧酸,故D错误.
故选C.
A、W为S元素,所形成的单质为分子晶体,故A错误;
B、X与Y在同一周期,同一周期从左到右元素的非金属性逐渐增强,则Y的非金属性较强,故B错误;
C、X为N元素,Z为Si元素,以共价键结合形成一种无机非金属材料Si3N4,故C正确;
D、Y为F元素,没有正价,最高化合价为0,不存在含氧酸,故D错误.
故选C.
点评:本题考查元素的物质结构性质的相互关系的应用,题目难度不大,注意根据元素所在的位置以及质子数关系正确推断元素的种类是解答该题的关键.

练习册系列答案
相关题目
 如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )
如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )| A、X元素最多可形成六种氧化物 | B、Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | C、X元素的非金属性比Y元素非金属性强 | D、Z和X能以共价键结合形成一种无机非金属材料 |