题目内容
已知ARn-阴离子的原子核内有N个中子,Wg ARn-阴离子中电子的物质的量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:质子数、中子数、核外电子数及其相互联系
专题:原子组成与结构专题
分析:由ARn-阴离子的原子核内有N个中子,则质子数为A-N,阴离子中,质子数+所带电荷数=核外电子数,据此计算该阴离子的核外电子数,再利用质量和质量数计算原子的物质的量,进而计算该阴离子的电子数;
解答:
解:由ARn-阴离子的原子核内有N个中子,则R的质子数为A-N,故ARn-阴离子的核外电子数为A-N+n,
Wg克ARn-阴离子的物质的量为
=
mol,
所以Wg克ARn-阴离子含有的电子的物质的量为
mol×(A-N+n)=
mol.
故选:C.
Wg克ARn-阴离子的物质的量为
| Wg |
| Ag/mol |
| W |
| A |
所以Wg克ARn-阴离子含有的电子的物质的量为
| W |
| A |
| W(A-N+n) |
| A |
故选:C.
点评:本题考查学生利用原子构成的简单计算,明确原子的物质的量的计算是解答本题的关键,注意电子的质量可忽略,质量数近似等于相对原子质量.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
下列微粒半径大小比较不正确的是( )
| A、原子半径Na>Mg |
| B、原子半径F<S |
| C、离子半径Mg2+>O2- |
| D、离子半径Cl->Ca2+ |
抗酸药中和胃里过多的盐碱地的化学方程式是:NaHCO3+HCl=NaCl+H2O+CO2↑,在这个反应中有关叙述正确的是( )
| A、中和1 mol HCl需要NaHCO3 82g |
| B、NaHCO3的速率与HCl的反应速率之比为1:2 |
| C、加入的NaHCO3量可以大大过量 |
| D、84g的NaHCO3可以中和36.5g的胃酸 |
近年来,建筑装潢装饰材料进入家庭,调进发现,经过装修的居室以中由装潢装饰材料缓慢释放出来的化学污染物浓度过高,影响健康.这些污染物中最常见的是( )
| A、CO |
| B、SO2 |
| C、甲醛、甲苯等有机物蒸气 |
| D、臭氧 |
中学化学实验中应用最广泛的仪器之一是滴瓶.滴瓶用于盛放各种溶液,关于滴瓶中滴管的使用,叙述不正确的是( )
| A、试管中滴加溶液时,滴管尖嘴要伸入试管口内,以防溶液滴到试管外 |
| B、不能将滴管水平拿持 |
| C、加完药品后可将滴管放回原瓶 |
| D、滴管除了原滴瓶外,不能放别的地方 |
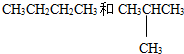 D.甲烷和庚烷E.液氯与氯气
D.甲烷和庚烷E.液氯与氯气 和
和