题目内容
(1)设某pH值的硫酸溶液中水的电离度为α1,相同pH值的硫酸铝溶液中水的电离度为α2,则α1α2.(填“>”“<”“═”).
(2)相同温度下,若硫酸和硫酸铝两种溶液的pH值均为3,那么硫酸溶液中水电离出的c(H+)是硫酸铝溶液中水电离出的c(H+)的 倍.
(3)相同温度下,若某pH值的硫酸溶液中水电离出的c(H+)=1.0×10-a mol.L-1,而相同pH值的硫酸铝溶液中水电离出的c(H+)=1.0×10-b mol.L-1,(已知a.b均小于14的正整数),那么a和b之间满足的数量关系是 (用一个等式和一个不等式表示)
(2)相同温度下,若硫酸和硫酸铝两种溶液的pH值均为3,那么硫酸溶液中水电离出的c(H+)是硫酸铝溶液中水电离出的c(H+)的
(3)相同温度下,若某pH值的硫酸溶液中水电离出的c(H+)=1.0×10-a mol.L-1,而相同pH值的硫酸铝溶液中水电离出的c(H+)=1.0×10-b mol.L-1,(已知a.b均小于14的正整数),那么a和b之间满足的数量关系是
考点:pH的简单计算,水的电离
专题:电离平衡与溶液的pH专题
分析:(1)酸或碱抑制水电离,含有弱离子的盐促进水电离;
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,硫酸中水电离出c(H+)=
,铝离子水解促进水电离,溶液中水电离出的c(H+)=10-pH;
(3)硫酸抑制水的电离,硫酸铝促进水的电离,则a>b,由pH相同,则10a-14=10-b.
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,硫酸中水电离出c(H+)=
| Kw |
| c(H+) |
(3)硫酸抑制水的电离,硫酸铝促进水的电离,则a>b,由pH相同,则10a-14=10-b.
解答:
解:(1)水电离生成H+和OH-,向溶液中加入稀硫酸,硫酸电离出氢离子抑制水电离,向溶液中加入硫酸铝,铝离子水解促进水电离,所以水的电离程度α1 <α2,故答案为:<;
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,硫酸中水电离出c(H+)=c(OH-)=
=
mol/L=10-11mol/L,铝离子水解促进水电离,溶液中水电离出的c(H+)=10-pH=10-3mol/L,所以硫酸溶液中水电离出的c(H+)是硫酸铝溶液中水电离出的c(H+)的
=10-8,
故答案为:10-8;
(3)硫酸抑制水的电离,硫酸铝促进水的电离,则a>b,由pH相同,则10a-14=10-b,则a+b=14,故答案为:a+b=14,a>b.
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,硫酸中水电离出c(H+)=c(OH-)=
| Kw |
| c(H+) |
| 10-14 |
| 10-3 |
| 10-11 |
| 10-3 |
故答案为:10-8;
(3)硫酸抑制水的电离,硫酸铝促进水的电离,则a>b,由pH相同,则10a-14=10-b,则a+b=14,故答案为:a+b=14,a>b.
点评:本题考查pH的简单计算,侧重考查分析计算能力,明确影响水电离的因素是解本题关键,易错点是计算酸中水电离出的氢离子浓度,难点是(3)题的计算,题目难度中等.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
将等体积的HnRO3和Hn+2RO4两种酸溶液与定量的NaOH中和都生成正盐,则这两种酸的物质的量浓度比是( )
| A、n:( n+2 ) |
| B、1:1 |
| C、1:( n+2 ) |
| D、(n+2):n |
以等质量的铂棒和铜棒作电极,电解硫酸铜溶液,通电一段时间后,其中一极增加质量为ag,此时两极的质量差可能为( )
| A、ag | ||
| B、2ag | ||
C、
| ||
| D、无法判断 |


 制成,合成路线如下:
制成,合成路线如下:

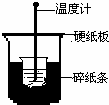 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: