题目内容
11.设NA为阿伏伽德罗常数的值,下列说法正确的是( )①常温常压下,17g甲基(-14CH3)中所含的中子数为9NA
②常温常压下,6.4gCu与40ml10mol•L-1浓HNO3作用,产生NO2分子的数目为0.2NA
③1.6g甲烷中含有的C-H键数目为0.1NA
④某温度时,1LpH=6的纯水中含有1.0×10-6NA个H+
⑤7.8g
 中含有的碳碳双键数目为0.3NA
中含有的碳碳双键数目为0.3NA⑥20g氖气中所含的原子数目为NA
⑦25℃时,pH=12的NaHCO3溶液中含有OH-的数目为0.01NA
⑧含NA个阴离子的Na2O2溶于水形成1L溶液,其浓度为1mol•L-1.
| A. | ①②⑦ | B. | ④⑥ | C. | ③⑤⑧ | D. | ②③⑤⑥ |
分析 ①求出17g甲基(-14CH3)的物质的量,然后根据甲基中含8个中子来分析;
②铜只有与浓硝酸反应才产生NO2分子;
③求出1.6g甲烷的物质的量,然后根据甲烷中含有的4条C-H键来分析;
④pH=6的纯水中氢离子的浓度为10-6mol/L;
⑤苯中不含碳碳双键;
⑥氖气由氖原子构成;
⑦溶液体积不明确;
⑧过氧化钠溶于水后生成氢氧化钠.
解答 解:①17g甲基(-14CH3)的物质的量为1mol,而甲基中含8个中子,故1mol甲基中含8NA个中子,故错误;
②铜只有与浓硝酸反应才产生NO2分子,当硝酸变稀时生成NO,故生成的二氧化氮分子个数小于0.2NA个,故错误;
③1.6g甲烷的物质的量为0.1mol,而甲烷中含有的4条C-H键,故0.1mol甲烷中含0.4NA条C-H键,故错误;
④pH=6的纯水中氢离子的浓度为10-6mol/L,故1L水中含有1.0×10-6NA个H+,故正确;
⑤苯不是单双键交替的结构,故不含碳碳双键,故错误;
⑥氖气由氖原子构成,故20g氖气中含有的氖原子的物质的量为1mol,故个数为NA个,故正确;
⑦溶液体积不明确,故溶液中的氢氧根的个数无法计算,故错误;
⑧过氧化钠溶于水后生成氢氧化钠,故所得的是氢氧化钠溶液,故错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
16.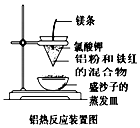 金属及其化合物渗透在生活中的方方面面,其对我们的生活影响很大.
金属及其化合物渗透在生活中的方方面面,其对我们的生活影响很大.
(1)铝热反应可以用于野外焊接钢轨.如图是某同学在实验室中进行
铝热反应(铝过量)的实验装置,实验中他观察到的现象之一为“纸漏斗
的下部被烧穿,有熔融物落入沙中”.
①根据装置图,判断该铝热反应的铝热剂为(写化学式)Al、Fe2O3.
②为定性检验铝热反应后的固体成分,请补充填写下表:
(2)某锂离子电池正极材料含有钴酸锂(LiCoO2),其正极材料可再生利用,其中一步反 应是在加热条件下利用硫酸酸化的双氧水和钴酸锂反应得到CoSO4,写出该反应的化学方程式2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+O2↑+4H2O
(3)纳米铁粉(Fe)可用于处理地下水中的污染物.一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为2Fe2++BH4-+4OH-=2Fe+2H2↑+B(OH)4-.
(4)某酸性工业废水中含有有毒的K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,现有1000L含 21.6mg/L的Cr2O72-溶液,需要27.0g草酸可以完全处理掉Cr2O72-(结果保留3位有效数字).
 金属及其化合物渗透在生活中的方方面面,其对我们的生活影响很大.
金属及其化合物渗透在生活中的方方面面,其对我们的生活影响很大.(1)铝热反应可以用于野外焊接钢轨.如图是某同学在实验室中进行
铝热反应(铝过量)的实验装置,实验中他观察到的现象之一为“纸漏斗
的下部被烧穿,有熔融物落入沙中”.
①根据装置图,判断该铝热反应的铝热剂为(写化学式)Al、Fe2O3.
②为定性检验铝热反应后的固体成分,请补充填写下表:
| 检验成分 | 操作步骤 | 实验现象与相关解释或结论 |
| 铝 | 取少量反应后的固体于试管中,加入足量NaOH溶液,振荡 | ①加入NaOH溶液后,固体部分溶解,用化学方程式解释原因Al2O3+2NaOH=2NaAlO2+H2O ②观察到有气泡产生,证明存在Al. |
| 铁红 | ①另取少量反应后的固体于试管中,加入足量稀硫酸, ②(继续填写后续操作)向试管中滴加KSCN溶液 | ①加入硫酸,固体全部溶解, ②现象为溶液变红色,则证明存在铁红 |
(3)纳米铁粉(Fe)可用于处理地下水中的污染物.一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为2Fe2++BH4-+4OH-=2Fe+2H2↑+B(OH)4-.
(4)某酸性工业废水中含有有毒的K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,现有1000L含 21.6mg/L的Cr2O72-溶液,需要27.0g草酸可以完全处理掉Cr2O72-(结果保留3位有效数字).
2.下列实验操作正确的是( )
| A. |  稀释浓硫酸 | B. |  加热液体 | C. |  点燃酒精灯 | D. |  称量NaOH固体 |
6. 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m 的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m 的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m 的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m 的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:X<Y<Z | |
| B. | 非金属性:X>Y>Z | |
| C. | q与s均为酸性氧化物 | |
| D. | X 的单质与Y 的单质在一定条件下能发生反应 |
16.下列说法正确的是( )
| A. | 氢氧燃料电池工作时,1mol H2在正极上失去2mol电子 | |
| B. | 0.1mol/LNa2CO3溶液加热后,溶液的CO32-的数目小于6.02×1022个 | |
| C. | 常温常压下,22.4LCl2中含有的分子数为6.02×1023个 | |
| D. | 室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力减弱 |




 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: