题目内容
(1)已知拆开1mol H-H键、1mol N≡N、1mol N-H键分别需要吸收的能量为436kJ、946kJ、39lkJ.则由N2和H2反应生成1molNH3需要 (填“放出”或“吸收”) 的热量.
(2)用电子式表示下列化合物的形成过程.
①H2O
②MgCl2 .
(2)用电子式表示下列化合物的形成过程.
①H2O
②MgCl2
考点:反应热和焓变,用电子式表示简单的离子化合物和共价化合物的形成
专题:化学用语专题,化学反应中的能量变化
分析:(1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
(2)根据各种物质的类别判电子式的不同,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构.
(2)根据各种物质的类别判电子式的不同,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构.
解答:
解:(1)在反应N2+3H2  2NH3中,
2NH3中,
断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,
吸收的能量少,放出的能量多,该反应为放热反应,生成2molNH3放出的热量为:2346kJ-2254kJ=92kJ,所以生成1molNH3放出的热量为
=46KJ.
故答案为:放出;46KJ.
(2)①H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为
故答案为:
②MgCl2为离子化合物,用电子式表示的形成过程为
故答案为:
 2NH3中,
2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,
吸收的能量少,放出的能量多,该反应为放热反应,生成2molNH3放出的热量为:2346kJ-2254kJ=92kJ,所以生成1molNH3放出的热量为
| 92KJ |
| 2 |
故答案为:放出;46KJ.
(2)①H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为

故答案为:

②MgCl2为离子化合物,用电子式表示的形成过程为

故答案为:

点评:本题考查反应热的计算,以及用电子式表示化学反应的形成过程,题目难度不大,注意相关基础知识的积累题目难度不大,注意把握从键能的角度计算反应热的方法.

练习册系列答案
相关题目
在理论上可用于设计原电池的化学反应是( )
| A、Fe+CuSO4=FeSO4+Cu |
| B、HCl+NaOH=NaCl+H2O |
| C、Na2O+H2O=2NaOH |
| D、CH4+2O2→CO2+2H2O |
下列各组粒子中核外电子总数相等的是( )
| A、K+ 和 Na+ |
| B、CO2和NO2 |
| C、CO和CO2 |
| D、NH2- 和CH5+ |
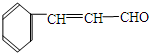 成分,由该物质制取分子式为C16H14O2的酯,过程如下(其他试剂、产物及反应条件均省略):
成分,由该物质制取分子式为C16H14O2的酯,过程如下(其他试剂、产物及反应条件均省略):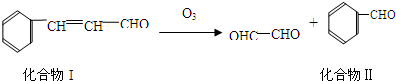

 如图所示(分子中只有C、H、O三种原子)为从八角中提取到的莽草酸的球棍模型.请回答下列问题:
如图所示(分子中只有C、H、O三种原子)为从八角中提取到的莽草酸的球棍模型.请回答下列问题: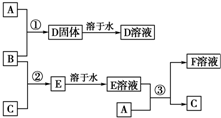 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按如图所示进行反应.又知E溶液是无色的,F溶液是浅绿色的.
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按如图所示进行反应.又知E溶液是无色的,F溶液是浅绿色的. 利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个原电池(正极材料用碳棒).装置图
利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个原电池(正极材料用碳棒).装置图