题目内容
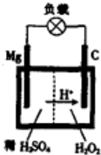
 某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:Ⅰ.①配制浓度均为0.5mol/L 的H2SO4和H2C2O4溶液.
②用
③分别称取除去表面氧化膜的镁带并系于铜丝末端.
④检查装置的气密性,在广口瓶中装满水,按图连接好装置.
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录
⑥反应结束后,读取量筒内水的体积为 y mL.
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84g/cm3 98%的浓H2SO4,配制浓度为250mL 0.5mol/L的H2SO4溶液,所需要的主要仪器有
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是
(4)铜丝不与酸接触的原因是
(5)在配制浓度为250mL 0.5mol/L的H2SO4溶液时,下列操作中的
①将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
②定容时俯视刻度线
③定容时仰视刻度线
④干净的容量瓶未经干燥就用于配制溶液.
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:Ⅰ.②滴定管精确度为0.01ml,依据溶液的性质选择滴定管类型;
⑤比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化
Ⅱ.(1)依据配置一定物质的量浓度溶液的一般步骤选择合适的仪器;
(2)要准确测量气体体积必须保持量筒内外气体的温度和压强相等,因此在读取量筒内气体的体积之前,应使试管和量筒内的气体都冷却至室温;再调节量筒内外液面高度使之相同;
(3)读数时要保持左右气体压强相等,以减少误差,可以向下移动量筒;
(4)根据镁与铜易形成原电池,加快反应速率,干扰实验测定解答;
(5)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=
分析溶液浓度误差.
⑤比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化
Ⅱ.(1)依据配置一定物质的量浓度溶液的一般步骤选择合适的仪器;
(2)要准确测量气体体积必须保持量筒内外气体的温度和压强相等,因此在读取量筒内气体的体积之前,应使试管和量筒内的气体都冷却至室温;再调节量筒内外液面高度使之相同;
(3)读数时要保持左右气体压强相等,以减少误差,可以向下移动量筒;
(4)根据镁与铜易形成原电池,加快反应速率,干扰实验测定解答;
(5)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=
| n |
| V |
解答:
解:Ⅰ.②:题中要求量取酸的体积10.00 mL较精确,应选酸式滴定管;
故答案为:酸式滴定管;
⑤比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化;
故答案为:反应所需时间;
Ⅱ.(1)配置一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀,用到的仪器有:250ml容量瓶、胶头滴管、烧杯、玻璃棒、酸式滴定管;
故答案为:250ml容量瓶、胶头滴管;
(2)因为排出的气体是需要用排出的水的体积衡量的,而反应前后的量筒温度是不同的,因此,反应终止应该先停止加热,待体系恢复到室温时,才取出导管.这一步操作跟通常的实验不同,所以停止加热时导管的出口要高于量筒内的液面,此时即使不取出导管而停止加热,也不会造成水的倒吸;停止加热、回到室温后,将量筒下移以调节量筒内的液面与水槽一致,此时量筒内气体压强也为大气压,读数才是正确的;所以正确的操作顺序为:②使气体都冷却至室温;①调整量筒内外液面高度使之相同;③读取量筒内气体的体积;
故答案为:②①③;
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是,向下移动量筒;
故答案为:下移丙;
(4)镁与铜易形成原电池,加快反应速率,干扰实验测定,所以铜丝不与酸接触,
故答案为:防止形成原电池,加快反应速率,干扰实验测定;
(5)①将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,导致溶质的物质的量偏小,溶液的浓度偏低,故①正确;
②定容时俯视刻度线,导致溶液的体积偏小,溶液的浓度偏高,故②错误;
③定容时仰视刻度线,导致溶液的体积偏大,溶液的浓度偏低,故③正确;
④干净的容量瓶未经干燥就用于配制溶液,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变,故④错误;
故选:①③.
故答案为:酸式滴定管;
⑤比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化;
故答案为:反应所需时间;
Ⅱ.(1)配置一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀,用到的仪器有:250ml容量瓶、胶头滴管、烧杯、玻璃棒、酸式滴定管;
故答案为:250ml容量瓶、胶头滴管;
(2)因为排出的气体是需要用排出的水的体积衡量的,而反应前后的量筒温度是不同的,因此,反应终止应该先停止加热,待体系恢复到室温时,才取出导管.这一步操作跟通常的实验不同,所以停止加热时导管的出口要高于量筒内的液面,此时即使不取出导管而停止加热,也不会造成水的倒吸;停止加热、回到室温后,将量筒下移以调节量筒内的液面与水槽一致,此时量筒内气体压强也为大气压,读数才是正确的;所以正确的操作顺序为:②使气体都冷却至室温;①调整量筒内外液面高度使之相同;③读取量筒内气体的体积;
故答案为:②①③;
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是,向下移动量筒;
故答案为:下移丙;
(4)镁与铜易形成原电池,加快反应速率,干扰实验测定,所以铜丝不与酸接触,
故答案为:防止形成原电池,加快反应速率,干扰实验测定;
(5)①将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,导致溶质的物质的量偏小,溶液的浓度偏低,故①正确;
②定容时俯视刻度线,导致溶液的体积偏小,溶液的浓度偏高,故②错误;
③定容时仰视刻度线,导致溶液的体积偏大,溶液的浓度偏低,故③正确;
④干净的容量瓶未经干燥就用于配制溶液,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变,故④错误;
故选:①③.
点评:本题为实验题,考查了一定物质的量浓度溶液的配置,熟悉配置原理是解题关键,注意排液法量取气体体积的原理和操作方法.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
下列实验操作或对实验事实的描述不正确的是( )
| A、不宜用瓷坩埚灼烧氢氧化钠或碳酸钠 |
| B、使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大 |
| C、分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出 |
| D、用托盘天平称量11.74 g氯化钠晶体 |
 恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件.下列有关说法中正确的是( )
恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件.下列有关说法中正确的是( )| A、Z和W在该条件下都不可能为气态 |
| B、t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
| C、若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
| D、若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等. |
铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶性的甲基磺酸铅为电解质,电池总反应为:Pb+PbO2+4H+
2Pb2++2H2O.下列有关新型液流式铅酸蓄电池的说法正确的是( )
| 放电 |
| 充电 |
| A、放电时负极反应式为Pb-2e-+SO42-=PbSO4 |
| B、充放电时,溶液的导电能力变化不大 |
| C、以该电池电解NaCl溶液时,当消耗207gPb时,在阳极生成Cl222.4L |
| D、充电时的阳极反应式为Pb 2++2e-+4OH-=PbO2+2H2O |
下面的排序不正确的是( )
| A、晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B、熔点由高到低:Na>Mg>Al |
| C、硬度由大到小:金刚石>碳化硅>晶体硅 |
| D、电负性由大到小:F>O>S |
在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子.则该硫酸盐的物质的量浓度为( )
| A、2 mol?L-1 |
| B、2.5 mol?L-1 |
| C、5 mol?L-1 |
| D、7.5 mol?L-1 |
欲除去氯气中的少量氯化氢气体,最好选用( )
| A、H2O |
| B、NaOH |
| C、饱和食盐水 |
| D、石灰水 |
 1808年,英国化学家用钾还原氧化镁,最早制得少量的镁.镁是航空工业的重要材料,镁作为一种强氧化剂,还用于钛、铍和铀的生产中.
1808年,英国化学家用钾还原氧化镁,最早制得少量的镁.镁是航空工业的重要材料,镁作为一种强氧化剂,还用于钛、铍和铀的生产中.