题目内容
5.下列实验能获得成功的是( )| A. | 苯和液溴用溴化铁作催化剂生成溴苯 | |
| B. | 向苯酚浓溶液中滴入少量浓溴水可观察到白色三溴苯酚沉淀 | |
| C. | 银氨溶液配制后加入稀硝酸使溶液呈酸性,再滴入乙醛溶液共热,有银镜生成 | |
| D. | 加氢氧化钠钠溶液,充分振荡,分液可除去乙酸乙酯中的乙酸 |
分析 A.液溴和苯在催化剂存在条件下反应生成溴苯;
B.三溴苯酚易溶于苯酚溶液,无法看到白色沉淀;
C.稀硝酸破坏了银氨溶液,不会生成银镜;
D.乙酸乙酯和乙酸都能够与氢氧化钠溶液反应,违反了除杂原则.
解答 解:解:A.液溴和苯在溴化铁催化作用下反应生成溴苯,故A正确;
B.苯酚和溴发生取代反应生成三溴苯酚,三溴苯酚易溶于苯酚,所以看不到白色沉淀,故B错误;
C.银镜反应需要在碱性条件下进行,银氨溶液配制后不能加入稀硝酸,否则不会生成银镜,应该直接滴入乙醛溶液共热,才能有银镜生成,故C错误;
D.乙酸乙酯能够与氢氧化钠溶液反应,不能用氢氧化钠除去乙酸乙酯中的乙酸,应该用饱和碳酸钠溶液,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的性质、物质或离子的检验、有机物的制备等,把握物质的性质、反应原理、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
1.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.4 g镁原子变成离子时,失去的电子数为0.3NA | |
| B. | 常温常压下,28 g氮气所含的原子数为2NA | |
| C. | 18 g H218O中含有的原子总数为3NA | |
| D. | 32 g氧气和4 g氦气所含原子数目相等,均为NA |
5.将amL的乙炔气体,通入盛有bg苯的试管中.则所得混合物中碳的质量分数为( )
| A. | $\frac{12}{13}$ | B. | $\frac{1}{7}$ | C. | $\frac{6}{7}$ | D. | 无法确定 |
10.在一密闭容器中,一定条件下,进行如下反应:2NO(g)+2CO(g)?N2(g)+2CO2(g);△H=-373.2kJ/mol,达到平衡后,为提高NO的转化率,采取的正确措施是( )
| A. | 升高温度和减小压强 | B. | 降低温度和减小压强 | ||
| C. | 降低温度和增大压强 | D. | 升高温度和增大压强 |
14.已知1-18号元素的离子aW3+、b X+、CY2-、d Z- 都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A. | 四种元素位于同一周期 | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 离子的氧化性aW3+>bX+ | D. | 原子序数:c>b |
15.一定条件下,下列各组物质中,Y既能与X反应又能与Z反应的有几组( )
| 序号 | X | Y | Z |
| ① | NaHSO4溶液 | Al(OH)3 | 稀硫酸 |
| ② | CaCl2溶液 | SO2 | CaSO3 |
| ③ | HF溶液 | Si | Ba(OH)2 |
| ④ | Fe Cl3溶液 | Fe | 浓硝酸 |
| A. | 1组 | B. | 2组 | C. | 3组 | D. | 4组 |
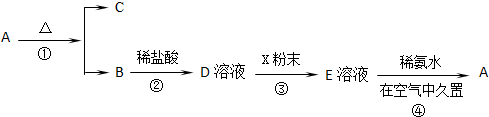
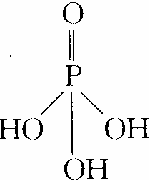 ),三聚磷酸钠是常用的水处理剂,次磷酸钠(Nail2Pa)可用于化学镀镍等等.完成下列填空:
),三聚磷酸钠是常用的水处理剂,次磷酸钠(Nail2Pa)可用于化学镀镍等等.完成下列填空: