题目内容
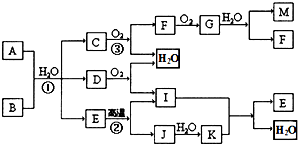
某金属氧化物化学式为M2O3,一个分子电子总数为50,每个M离子含10个电子,若其中每个氧原子核内有8个中子,M2O3相对分子质量102,则M原子核内中子数为( )
| A、14 | B、16 | C、10 | D、21 |
考点:质量数与质子数、中子数之间的相互关系
专题:原子组成与结构专题
分析:先根据M2O3的相对分子质量求出M的相对原子质量,然后根据M2O3的电子数求出M原子的电子数,最后根据中子数=质量数-质子数来解答.
解答:
解:因M2O3的相对分子质量为102,则M的相对原子质量为
=27,因M2O3的电子数为50,则一个M原子的电子数为
=13,所以中子数=质量数-质子数=27-13=14,
故选A.
| 102-16×3 |
| 2 |
| 50-8×3 |
| 2 |
故选A.
点评:本题主要考查了中子数、质量数、质子数的关系,难度不大,需要注意的是相对原子质量约等于质量数.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列离子方程式书写正确的是( )
| A、氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2C1- |
| B、金属钠投入水中Na+H2O=Na++OH-+H2↑ |
| C、氢氧化亚铁溶于稀硝酸Fe(OH)2+2H+=Fe2++2H2O |
| D、氯化铁溶液中加过量氨水3NH3?H2O+Fe3+=3NH4++Fe(OH)3↓ |
下列有关溶液中粒子浓度的关系中,正确的是( )
| A、pH相同的①CH3COONa、②NaHCO3、③Na[Al(OH)4]三种溶液中的c(Na+):②>③>① |
| B、10mL0.1mol?L-1CH3COOH溶液与20mL0.1mol?L-1NaOH溶液混合后,溶液中离子浓度关系:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
| C、a L0.1mol?L-1CH3COOH溶液与b L 0.1mol?L-1NaOH溶液混合,若a<b,则不一定存在:n(OH-)-n(H+)>0.1(b-a) |
| D、某温度下0.1mol?L-1NaHB溶液中一定存在:c(Na+)≥c(B2-)且pH<7 |
设NA阿伏加德罗常数的值,下列说法正确的是( )
| A、0.1mol金属铁与足量稀硫酸充分反应,生成0.1mol硫酸铁 |
| B、常温常压下,9 g H2O中含有的分子数为NA |
| C、标准状况下,11.2 L SO2中含有的氧原子数为NA |
| D、1 g12C中所含有的碳原子数为NA |
在铝土制备金属铝的三个主要操作:①酸化,②灼烧,③电解,其中没有发生过的化学反应类型是( )
| A、氧化还原反应 | B、复分解反应 |
| C、分解反应 | D、置换反应 |
 0.60g某饱和一元醇A,与足量的金属钠反应,生成氢气112mL(标准状况).求该一元醇的分子式
0.60g某饱和一元醇A,与足量的金属钠反应,生成氢气112mL(标准状况).求该一元醇的分子式