题目内容
在一定条件下CO、CH4燃烧的热化学方程式分别为:CO(g)+
O2(g)=CO2(g),△H=-283kJ?mol-1;CH4(g)+202(g)=C02(g)+2H20(1),△H=-890kJ?mol-1.现有标准状况下89.6L由 CO和CH4组成的混合气体在上述条件下完全燃烧时,释放出2953kJ的热量,求混合气体中CO、CH4两种气体的物质的量之比.
| 1 |
| 2 |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:依据n=
计算气体总的物质的量,再结合热化学方程式中焓变和方程式系数的关系计算.
| V |
| Vm |
解答:
解:标准状况下89.6L由 CO和CH4组成的混合气体,n=
=
=4mol,
根据CH4和CO的燃烧热可知,各物质燃烧的热化学方程式:
①CO(g)+
O2(g)=CO2(g),△H=-283kJ?mol-1;
②CH4(g)+202(g)=C02(g)+2H20(1),△H=-890kJ?mol-1,
令CO和CH4的物质的量分别为xmol、ymol,
CO(g)+
O2(g)=CO2(g),△H=-283kJ?mol-1
1 283.0KJ
x 283x KJ
CH4(g)+202(g)=C02(g)+2H20(1),△H=-890kJ?mol-1,
1 890.0KJ
y 890y KJ
则x+y=4;
283x+890y=2953kJ,
解得x=1mol、y=3mol,
则CO与CH4的体积比为1:3,
故答案为:1:3.
| V |
| Vm |
| 89.6L |
| 22.4mol/L |
根据CH4和CO的燃烧热可知,各物质燃烧的热化学方程式:
①CO(g)+
| 1 |
| 2 |
②CH4(g)+202(g)=C02(g)+2H20(1),△H=-890kJ?mol-1,
令CO和CH4的物质的量分别为xmol、ymol,
CO(g)+
| 1 |
| 2 |
1 283.0KJ
x 283x KJ
CH4(g)+202(g)=C02(g)+2H20(1),△H=-890kJ?mol-1,
1 890.0KJ
y 890y KJ
则x+y=4;
283x+890y=2953kJ,
解得x=1mol、y=3mol,
则CO与CH4的体积比为1:3,
故答案为:1:3.
点评:本题考查反应热的有关计算,题目难度中等,关键是根据化学方程式理顺物质的量与放出的热量之间的关系.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
下列关于反应热的表述正确的是( )
| A、当△H<0时,表示该反应为吸热反应 |
| B、需要加热才能进行的反应是吸热反应 |
| C、反应热的大小与反应物所具有的能量和生成物所具有的能量有关 |
| D、1molNaOH分别和1molCH3COOH、1molHNO3反应放出的热量:CH3COOH=HNO3 |
 某同学按如图所示的装置进行电解实验.下列说法正确的是( )
某同学按如图所示的装置进行电解实验.下列说法正确的是( )| A、电解过程中,铜电极上有H2产生 | ||||
| B、电解一定时间后,石墨电极不可能有铜析出 | ||||
C、电解初期,主反应方程式为:Cu+H2SO4
| ||||
| D、整个电解过程中,H+的浓度不断增大 |
据报道,科学家正在研究用容量更大的锌电池取代铅蓄电池,其电池反应式为2Zn+O2═2ZnO,原料是锌料、电解质溶液、空气.下列叙述中正确的是( )
| A、Zn是电池的正极 |
| B、负极反应:Zn-2e--═Zn2+ |
| C、正极发生氧化反应 |
| D、电解质溶液应选择稀硫酸 |
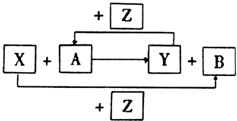 X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见化合物.它们在一定条件下可以发生如图反应(均不是在溶液中进行的反应)(以下每个空中只需填入一种物质)
X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见化合物.它们在一定条件下可以发生如图反应(均不是在溶液中进行的反应)(以下每个空中只需填入一种物质)