题目内容
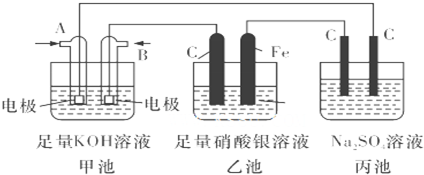
对于反应mA(g)+nB(g)?pC(g)+qD(g) 满足下列图象,根据图象判断四种关系正确的是( )

| A、m+n>p+q,正反应吸热 |
| B、m+n<p+q,正反应放热 |
| C、m+n>p+q,正反应放热 |
| D、m+n<p+q,正反应吸热 |
考点:化学平衡建立的过程,物质的量或浓度随时间的变化曲线,转化率随温度、压强的变化曲线
专题:图示题
分析:由图1可知,T2>T1,升高温度,C的百分含量减小,说明平衡向逆反应方向移动,则正反应为放热反应;
由图2采取“定一议二”原则分析,根据等压线,由温度对A的转化率影响,判断升高温度平衡移动方向,确定反应吸热与放热;作垂直横轴的线,温度相同,比较压强对A的转化率的影响,判断增大压强平衡移动方向,确定m+n与p+g的大小关系.
由图2采取“定一议二”原则分析,根据等压线,由温度对A的转化率影响,判断升高温度平衡移动方向,确定反应吸热与放热;作垂直横轴的线,温度相同,比较压强对A的转化率的影响,判断增大压强平衡移动方向,确定m+n与p+g的大小关系.
解答:
解:由图1可知,T2>T1,升高温度,C的百分含量减小,说明平衡向逆反应方向移动,则正反应为放热反应;或者由图2可知,压强相同时,温度越高A的转化率越小,说明升高温度平衡逆正反应移动,故正反应为放热反应,再作垂直横轴的线,由图2可知,温度相同,压强越大A的转化率越大,说明增大压强平衡向正反应移动,故正反应为气体物质的量减小的反应,即m+n>p+q,
故选:C.
故选:C.
点评:本题考查化学平衡图象、化学平衡的影响因素等,难度不大,注意采取“定一议二”原则分析解答.

练习册系列答案
相关题目
一定温度下,可逆反应:A(s)+2B(g)?2C(g)+D(g)△H<0 在甲、乙两容器中进行.起始时,将 1mol A 和 2molB 加入甲容器中,将 4molC 和 2mol D 加入乙容器中,此时控制活塞 P,使乙的容积为甲的 2 倍,t1 时两容器内均达到平衡状态(如图所示,隔板 K 不能移动).下列说法正确的是( )
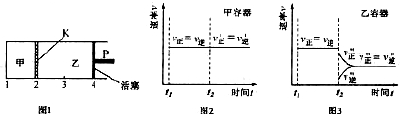

| A、保持温度和活塞位置不变,在甲中再加入 1molA 和 2molB,达到新的平衡后,甲中压强是乙中压强的2倍 |
| B、保持温度和活塞位置不变,t2 时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1 前的反应速率变化已省略) |
| C、保持温度不变,移动活塞 P,使乙的容积和甲相等,达到新的平衡后,乙中 C 的体积分数是甲中C的体积分数的 2 倍 |
| D、保持温度不变,移动活塞 P,使乙的容积和甲相等,达到新的平衡后,乙中气体密度比甲中气体密度的 2 倍小 |
金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述不正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
| A、阳极发生还原反应,其电极反应式为:Ni2++2e-═Ni |
| B、电解过程中,阳极质量的减少与阴极质量的增加不相等,但阴阳两极得失电子数目相等 |
| C、电解后,溶液中存在的金属阳离子有Ni2+、Fe2+和Zn2+ |
| D、电解后,电解槽底部的阳极泥中有Cu和Pt |
某兴趣小组为探究温度、压强对可逆反应A(g)+B(g)??C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的量浓度为[浓度1].然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各物质的量浓度为[浓度2]、[浓度3].
请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是( )
| A | B | C | |
| 浓度1 | 0.05mol?L-1 | a mol?L-1 | 0.05 mol?L-1 |
| 浓度2 | 0.078 mol?L-1 | 0.078 mol?L-1 | 0.122 mol?L-1 |
| 浓度3 | 0.06 mol?L-1 | 0.06 mol?L-1 | 0.04 mol?L-1 |
| 浓度4 | 0.07 mol?L-1 | 0.07 mol?L-1 | 0.098 mol?L-1 |
| A、由[浓度3]与[浓度1]的比较,可判断出正反应是放热反应 |
| B、由[浓度2]与[浓度1]的比较,可判断平衡移动的原因是升高温度 |
| C、[浓度1]中a=0.05 |
| D、该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4].与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差 |
下列有关原子结构和元素周期律叙述中不正确的是( )
| A、第IA族碱金属元素最高价氧化物的水化物的碱性随原子序数递增而增强 |
| B、同周期元素(除0族元素外)从左到右,原子半径和离子半径都逐渐减小 |
| C、第ⅦA元素从上到下,其氢化物的稳定性逐渐减弱 |
| D、第ⅦA族元素是同周期中非金属性最强的元素 |
下列各种说法中不正确的是( )
| A、SO2、NO2、CO、烟尘均是大气污染物 |
| B、两支分别蘸有浓盐酸和浓氨水的玻璃棒靠近会产生白烟 |
| C、只用溴水就能区别出乙醇、乙酸、苯三种无色液体 |
| D、一定量的甲烷与氯气光照下发生反应,生成物有五种 |
化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是( )
| A、检验溶液中是否含有SO32-时,用HNO3酸化后再加BaCl2溶液 |
| B、为提高KMnO4溶液的氧化能力,用盐酸酸化KMnO4溶液 |
| C、检验某溶液是否含有Fe3+时,用HNO3酸化后,加KSCN溶液 |
| D、检验溶液中是否含有SO42-时,用HCl酸化后,加BaCl2溶液 |