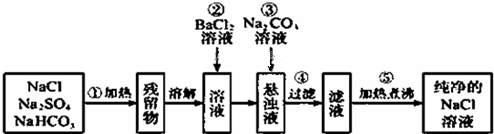
题目内容
金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述不正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
| A、阳极发生还原反应,其电极反应式为:Ni2++2e-═Ni |
| B、电解过程中,阳极质量的减少与阴极质量的增加不相等,但阴阳两极得失电子数目相等 |
| C、电解后,溶液中存在的金属阳离子有Ni2+、Fe2+和Zn2+ |
| D、电解后,电解槽底部的阳极泥中有Cu和Pt |
考点:电解原理
专题:电化学专题
分析:A、阳极失去电子发生氧化反应;
B、阳极失电子的有Fe、Zn、Cu,阴极析出的是铜,依据电子守恒计算分析;
C、精炼过程中,电解质溶液中一定含有Ni2+;
D、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和铂不失电子沉降电解池底部形成阳极泥.
B、阳极失电子的有Fe、Zn、Cu,阴极析出的是铜,依据电子守恒计算分析;
C、精炼过程中,电解质溶液中一定含有Ni2+;
D、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和铂不失电子沉降电解池底部形成阳极泥.
解答:
解:A、阳极发生氧化反应,其电极反应式:Ni-2e-=Ni2+,Fe-2e-=Fe2+,Zn-2e-=Zn2+,故A错误;
B、电解过程中阳极失电子的有Fe、Zn、Cu;阴极析出的是铜,依据电子守恒,阳极质量的减少与阴极质量的增加不相等,故B正确;
C、电解后,溶液中存在的金属阳离子有Fe2+、Zn2+、Ni2+,故C正确;
D、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和pT不失电子沉降电解池底部形成阳极泥,电解后,电解槽底部的阳极泥中只有Cu和Pt,故D正确;
故选A.
B、电解过程中阳极失电子的有Fe、Zn、Cu;阴极析出的是铜,依据电子守恒,阳极质量的减少与阴极质量的增加不相等,故B正确;
C、电解后,溶液中存在的金属阳离子有Fe2+、Zn2+、Ni2+,故C正确;
D、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和pT不失电子沉降电解池底部形成阳极泥,电解后,电解槽底部的阳极泥中只有Cu和Pt,故D正确;
故选A.
点评:本题考查了电极原理的应用,主要考查电解精炼镍的原理分析判断,题目难度中等.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
下列最简式中,没有相对分子质量也可以确定分子式的是( )
| A、CH2O |
| B、CH2 |
| C、CH |
| D、C2H5 |
“低碳生活”已成为热门话题.下列环境问题与CO2的排放有关的是( )
| A、酸雨 | B、白色污染 |
| C、臭氧层破坏 | D、温室效应 |
人类只有一个地球,保护地球环境人人有责.下列做法能达到相应目的是( )
| A、及时焚烧废弃塑料减少“白色污染” |
| B、工厂用高烟囱排放废气防止“酸雨” |
| C、使用车用乙醇汽油防止“温室效应” |
| D、推广使用无氟冰箱防止“臭氧空洞” |
150℃、101kPa时,由两种烃组成的混合气体0.5L在4.5L O2中完全燃烧,测得反应后气体总体积小于5L,其中含CO2 0.8L,则生成水蒸汽的体积为( )
| A、0.7 L |
| B、1.4 L |
| C、1.6 L |
| D、2.8 L |
对于反应mA(g)+nB(g)?pC(g)+qD(g) 满足下列图象,根据图象判断四种关系正确的是( )

| A、m+n>p+q,正反应吸热 |
| B、m+n<p+q,正反应放热 |
| C、m+n>p+q,正反应放热 |
| D、m+n<p+q,正反应吸热 |