题目内容
铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):下列计算结果正确的是( )
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | v |
| A、硝酸的浓度为6mol/L |
| B、①中溶解了5.6gFe |
| C、②中溶解了9.6gCu |
| D、④中v=8960 |
考点:有关混合物反应的计算
专题:
分析:由表中数据可知,实验①②都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为:18g-9.6g=8.4g,生成NO的体积为:4480mL-2240mL=2240mL,NO物质的量为0.1mol,根据电子转移守恒可知,参加反应金属的物质的量为:
=0.15mol,参加反应金属的平均摩尔质量为:
=56g/mol,故该过程只有Fe参加反应,故实验①只有Fe参与反应,根据NO的体积结合方程式计算硝酸的物质的量、参加反应Fe的物质的量,根据c=
计算硝酸的物质的量浓度,根据m=nM计算参加反应Fe的质量;
在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为:6720mL-4480mL=2240mL,NO物质的量为0.1mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量为:
=0.15mol,Cu的质量为:0.15mol×64g/mol=9.6g,等于参加反应金属的质量,故该过程只有Cu反应,且Cu恰好完全反应,故加入200mL硝酸时,Fe恰好反应生成硝酸亚铁,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,根据亚铁离子的物质的量,利用电子转移守恒计算该阶段生成NO的物质的量,再根据V=nVm计算该阶段生成NO的体积,进而计算V的值.
| 0.1mol×(5-2) |
| 2 |
| 8.4g |
| 1.5mol |
| n |
| V |
在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为:6720mL-4480mL=2240mL,NO物质的量为0.1mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量为:
| 0.1mol×(5-2) |
| 2 |
解答:
解:由表中数据可知,实验①②都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为18g-9.6g=8.4g,生成NO的体积为4480mL-2240mL=2240mL,NO物质的量为0.1mol,根据电子转移守恒可知,参加反应金属的物质的量为:
=0.15mol,参加反应金属的平均摩尔质量为:
=56g/mol,故该过程只有Fe参加反应,故实验①只有Fe参与反应,
在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为6720mL-4480mL=2240mL,NO物质的量为0.1mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量为:
=0.15mol,Cu的质量为:0.15mol×64g/mol=9.6g,等于参加反应金属的质量,故该过程只有Cu反应,且Cu恰好完全反应,故加入200mL硝酸时,Fe恰好反应生成硝酸亚铁,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,
A.由分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为:
=0.1mol,根据方程式可知,参加反应的硝酸的物质的量为0.1mol×4=0.4mol,故硝酸的物质的量浓度为:
=4mol/L,故A错误;
B.由分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为0.1mol,根据方程式可知,参加反应的Fe的物质的量为0.1mol×
=0.15mol,故参加反应Fe的质量为:0.15mol×56g/mol=8.4g,故B错误;
C.由上述分析可知,实验②中参加反应的金属为Fe,Cu没有参加反应,故C错误;
D.由上述分析可知,实验②中Fe与硝酸恰好反应生成硝酸亚铁,生成NO的物质的量为:
=0.2mol,由3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O可知,溶液中亚铁离子的物质的量为0.3mol,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,根据电子转移守恒可知,生成NO的物质的量为:
=0.1mol,故生成NO的体积为:0.1mol×22.4L/mol=2.24L=2240mL,故V=6720+2240=8960,故D正确;
故选D.
| 0.1mol×(5-2) |
| 2 |
| 8.4g |
| 1.5mol |
在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为6720mL-4480mL=2240mL,NO物质的量为0.1mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量为:
| 0.1mol×(5-2) |
| 2 |
A.由分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为:
| 2.24L |
| 22.4L/mol |
| 0.4mol |
| 0.1L |
B.由分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为0.1mol,根据方程式可知,参加反应的Fe的物质的量为0.1mol×
| 3 |
| 2 |
C.由上述分析可知,实验②中参加反应的金属为Fe,Cu没有参加反应,故C错误;
D.由上述分析可知,实验②中Fe与硝酸恰好反应生成硝酸亚铁,生成NO的物质的量为:
| 4.48L |
| 22.4L/mol |
| 0.3mol×(3-2) |
| 5-2 |
故选D.
点评:本题考查混合物的有关计算,题目难度较大,根据表中数据判断各阶段发生的反应是关键,侧重对学生综合能力的考查,过程复杂、计算量较大,为易错题目,试题充分考查了学生的分析、理解能力及化学计算能力.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
在铝土制备金属铝的三个主要操作:①酸化,②灼烧,③电解,其中没有发生过的化学反应类型是( )
| A、氧化还原反应 | B、复分解反应 |
| C、分解反应 | D、置换反应 |
下列有关离子方程式书写正确的是( )
| A、向含1molFeI2溶液中通入标准状况下22.4L Cl2:2Fe2++2I-+2Cl2=2Fe3+I2+4Cl- |
| B、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| C、将少量SO2气体通入NaClO溶液中 SO2+2ClO-+H2O=SO32-+2HClO |
| D、SiO2与NaOH溶液反应:SiO2+2OH-=SiO32-+H2O |
A、B分别是M元素的碳酸盐和碳酸氢盐,将一定量A、B的混合物与足量盐酸反应,消耗HCl与CO2的物质的量之比为3:2.已知M可能是ⅠA族或ⅡA族元素,则混合物中A、B的物质的量之比可能是( )
| A、3:1 | B、2:1 |
| C、1:2 | D、1:4 |
下列操作中正确的是( )
A、 |
B、 |
C、 |
D、 |
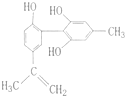 2008年北京奥运会坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现.某种兴奋剂的结构简式如图所示,有关该物质及其溶液的说法错误的是( )
2008年北京奥运会坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现.某种兴奋剂的结构简式如图所示,有关该物质及其溶液的说法错误的是( )| A、该分子中所有氢原子不可能在同一个平面上 |
| B、1 mol该物质与H2反应时,最多消耗7 molH2 |
| C、加入浓溴水,既可发生取代反应,又可发生加成反应 |
| D、滴入酸性高锰酸钾溶液,紫色褪去,可证明其结构中存在碳碳双键 |
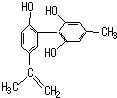 坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现.某种兴奋剂的结构简式如图所示,有关该物质及其溶液的说法不正确的是( )
坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现.某种兴奋剂的结构简式如图所示,有关该物质及其溶液的说法不正确的是( )| A、该分子中所有氢原子不可能在同一个平面上 |
| B、1 mol该物质与H2反应时,最多消耗7 molH2 |
| C、加入FeCl3溶液呈紫色,因为该物质属于酚类物质 |
| D、滴入酸性高锰酸钾溶液,紫色褪去,可证明结构中存在碳碳双键 |