题目内容
 X、Y、Z为三种短周期元素,原子序数之和为32,X和Y为相邻周期的元素,Y和Z为同周期的元素.Y的质子数比X多5个,X的最外层电子数为Y最外层电子数的2倍,X的最外层电子数和Z的最外层电子数之和为7;W+中所有电子正好充满K、L、M三个电子层.
X、Y、Z为三种短周期元素,原子序数之和为32,X和Y为相邻周期的元素,Y和Z为同周期的元素.Y的质子数比X多5个,X的最外层电子数为Y最外层电子数的2倍,X的最外层电子数和Z的最外层电子数之和为7;W+中所有电子正好充满K、L、M三个电子层.(1)X为
(2)W+与X2-形成的晶体结构如图所示.在1个W2X晶胞中,所包含的W的数目为
(3)X与氟元素形成的XF2分子的立体构型名称为
(4)XF2的结构与H2O的结构相似,但分子的极性很小,试从分子的立体构型,原子的电负性,中心原子孤对电子的角度作出解释
①电负性F:4.0 O:3.5 H:2.1 S:2.5 Be:1.5
从电负性上看,氧与氢的电负性差值
②从中心原子孤对电子的角度看,XF2分子中心原子有
考点:晶胞的计算,元素电离能、电负性的含义及应用,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:X、Y、Z为三种短周期元素,即在前三周期,X和Y为相邻周期的元素,Y的质子数比X多5个,则X、Y在第一周期和第二周期或在第二周期和第三周期,如果X、Y在第一周期和第二周期,由于X的最外层电子数为Y最外层电子数的2倍,则X最外层只能是2,即为氦元素,Y的质子数比X多5个,即Y为7号氮元素,而此时最外层不能满足2倍的关系,故X在第二周期、Y在第三周期,设Y元素的最外层电子数为a,则X元素的最外层电子数为2a,根据Y的质子数比X多5个,有2+8+a-(2+2a)=5,得a=3,可知X元素为6号元素氧元素、Y为13号元素铝元素,由X、Y、Z原子序数之和为32,所以Z为11号元素,即钠元素;W+中所有电子正好充满K、L、M三个电子层,即为2、8、18结构,所以W核外共有29个电子,即29号元素,铜元素,据此答题;
解答:
解:X、Y、Z为三种短周期元素,即在前三周期,X和Y为相邻周期的元素,Y的质子数比X多5个,则X、Y在第一周期和第二周期或在第二周期和第三周期,如果X、Y在第一周期和第二周期,由于X的最外层电子数为Y最外层电子数的2倍,则X最外层只能是2,即为氦元素,Y的质子数比X多5个,即Y为7号氮元素,而此时最外层不能满足2倍的关系,故X在第二周期、Y在第三周期,设Y元素的最外层电子数为a,则X元素的最外层电子数为2a,根据Y的质子数比X多5个,有2+8+a-(2+2a)=5,得a=3,可知X元素为6号元素氧元素、Y为13号元素铝元素,由X、Y、Z原子序数之和为32,所以Z为11号元素,即钠元素;W+中所有电子正好充满K、L、M三个电子层,即为2、8、18结构,所以W核外共有29个电子,即29号元素,铜元素,
(1)由上面的分析可知,X为 O,Y为 Al,Z为 Na,W为 Cu;
(2)根据均摊法可知,在图中空心球的个数为1+8×
=2,实心球的个数为4,所以空心球和实心球的个数比为1:2,结合化学式Cu2O可知,图中的空心球代表Cu+离子,其个数为4,故答案为:4;
(3)在OF2中,O原子的价层电子对数为
=4,孤电子对数为
=2,所以OF2的空间构型为V形,故答案为:V形;
(4)①氧与氢的电负性差值=3.5-2.1=1.4,氧与氟的电负性差值=3.5-4.0=-0.5,所以氧与氢的电负性差值>氧与氟的电负性差,故答案为:>;
②在OF2中,O原子的孤电子对数为
=2,在OF2中氟的电负性大于氧,所以共用电子对偏向于氟,故答案为:2、F;
(1)由上面的分析可知,X为 O,Y为 Al,Z为 Na,W为 Cu;
(2)根据均摊法可知,在图中空心球的个数为1+8×
| 1 |
| 8 |
(3)在OF2中,O原子的价层电子对数为
| 6+2 |
| 2 |
| 6-2 |
| 2 |
(4)①氧与氢的电负性差值=3.5-2.1=1.4,氧与氟的电负性差值=3.5-4.0=-0.5,所以氧与氢的电负性差值>氧与氟的电负性差,故答案为:>;
②在OF2中,O原子的孤电子对数为
| 6-2 |
| 2 |
点评:本题主要考查了根据元素在周期表中的位置及原子结构特点推断元素种类,并在此基础上考查分子空间构型、晶胞结构、电负性等知识,中等难度,解题的难点在X、Y元素的确定.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
设NA表示阿佛加德罗常数,下列说法正确的是( )
| A、33.6L(常温常压)氯气与2.7g铝充分反应,转移电子数为0.3NA |
| B、在标准状况下,22.4L CH2Cl2中含有的氢原子数为2NA |
| C、标准状况下,22.4L己烷含有的共价键数目为19NA |
| D、46gNO2气体在标准状况下的体积为22.4L |
下列关于苯酚的叙述不正确的是( )
| A、苯酚是一种弱酸,滴加指示剂变色 |
B、苯酚在水溶液中能按下式电离: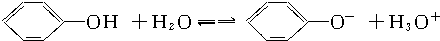 |
| C、苯酚钠在水溶液中几乎不能存在,会水解生成苯酚,所以苯酚钠溶液显碱性 |
| D、苯酚有腐蚀性,溅在皮肤上可用酒精冲洗 |
卤族元素有F、Cl、Br、I、At等元素,下列关于At的推断不正确的是( )
| A、At2的颜色比I2深 |
| B、HAt的水溶液的酸性比盐酸强 |
| C、AgAt不溶于水 |
| D、HAt很稳定,受热不易分解 |
下列热化学方程式正确的是( )
| A、甲烷的标准燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 | ||
| B、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-38.6 kJ?mol-1 | ||
C、已知在120℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为:H2(g)+
| ||
| D、25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ?mol-1,硫酸溶液与氢氧化钾溶液反应的热化学方程式为 H2SO4(aq)+2KOH(aq)═K2SO4(aq)+2H2O(l)△H=-57.3 kJ?mol-1 |
 利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).