题目内容
1.反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在 5L密闭容器中进行,30秒后,NO的物质的量增加了0.3mol,则此反应的平均速率v(NO)( )| A. | 0.0l mol•L-1•s-1 | B. | 0.002 mol•L-1•s-1 | ||
| C. | 0.06mol•L-•1s-1 | D. | 0.0025mol•L-1•s-1 |
分析 根据△c=$\frac{△n}{V}$计算NO的浓度变化量,再根据v=$\frac{△c}{△t}$计算v(NO).
解答 解:30s后NO的物质的量增加了0.3mol,则△c(NO)=$\frac{0.3mol}{5L}$=0.06mol/L,
故v(NO)=$\frac{0.06mol/L}{30s}$=0.002mol/(L•s),
故选B.
点评 本题考查化学反应速率的计算,比较基础,注意对公式的理解与灵活运用.

练习册系列答案
相关题目
11.下列递变情况中正确的是( )
| A. | HF、HCl、HBr、HI的沸点依次升高 | B. | HF、HCl、HBr、HI还原性依次增强 | ||
| C. | HF、HCl、HBr、HI稳定性依次增强 | D. | HF、HCl、HBr、HI酸性依次增强 |
12.下列关于实验原理或操作的叙述中,不正确的是( )
| A. | 从溴水中提取单质溴时,不能用无水乙醇代替CCl4 | |
| B. | 可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油 | |
| C. | 用纸层析法分离Cu2+和Fe3+,滤纸上端呈棕黄色,说明Fe3+在固定相中分配的更多 | |
| D. | 纸层析实验中,不能将滤纸上的试样点浸入展开剂中 |
9.在CH3COOH?H++CH3COO-的电离平衡中,要使电离平衡向左移动,应采取的措施是( )
| A. | 加冰醋酸 | B. | 加CH3COONa | C. | 加水 | D. | 加NaOH |
6.下列各组物质中化学键的类型相同的是( )
| A. | HF MgCl2 NH4Cl | B. | H2S Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH C H4 | D. | NH3 H2O CS2 |
13.某原电池总反应的离子方程式为:2Fe3++Fe=3Fe2+,不能实现该反应的原电池是( )
| A. | 正极为Cu,负极为Fe,电解质为FeCl3溶液 | |
| B. | 负极为Fe,正极为C,电解质为Fe(NO3)2溶液 | |
| C. | 正极为Ag,负极为Fe,电解质为Fe2(SO4)3溶液 | |
| D. | 负极为Fe,正极为Pt,电解质为Fe2(SO4 )3溶液 |
10.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(1)M的离子结构示意图为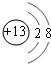 ;元素T基态原子的价电子排布式为3s23p5.
;元素T基态原子的价电子排布式为3s23p5.
(2)J和氢组成的化合物分子有6个原子,其结构简式为CH2=CH2
(3)M和R形成的化合物遇水会发生剧烈的反应,反应的化学方程式为Al2S3+6H2O=2Al(OH)3↓+3H2S↑.
(4)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,反应后的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是ac(选填序号).
③据报道,“L5+”是带正电荷的分子碎片,它的结构尚不清楚.其结构应该是对称的,5个L排成V形,且都达到8电子结构.则L5+可能的结构式是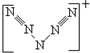 ,其中可能含有4个σ键,4个π键,4对孤电子对.
,其中可能含有4个σ键,4个π键,4对孤电子对.
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ. 该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.
| J | ||||
| R |
 ;元素T基态原子的价电子排布式为3s23p5.
;元素T基态原子的价电子排布式为3s23p5.(2)J和氢组成的化合物分子有6个原子,其结构简式为CH2=CH2
(3)M和R形成的化合物遇水会发生剧烈的反应,反应的化学方程式为Al2S3+6H2O=2Al(OH)3↓+3H2S↑.
(4)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,反应后的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是ac(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物总物质的量 |
 ,其中可能含有4个σ键,4个π键,4对孤电子对.
,其中可能含有4个σ键,4个π键,4对孤电子对.(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ. 该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.
11.设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1molC20H42中含有的共价键数目为60nA | |
| B. | 1molCl2通过足量的NaOH溶液中充分反应转移的电子数为nA | |
| C. | a g 某气体含分子数为b,c g 该气体在标况下的体积为22.4bc/(a nA)升 | |
| D. | 2.24L(标况)辛烷在32 g 氧气中充分燃烧,生成CO2的分子数为0.8nA |