题目内容
14.下列说法正确的是( )| A. | 阿司匹林是熟知的解热镇痛的药物,化学名为水杨酸 | |
| B. | 长期的大量使用阿司匹林会出现水杨酸中毒.应停药,并注射Na2CO3溶液 | |
| C. | 青霉素是重要的抗生素,它是一类弱碱性物质 | |
| D. | 毒品是指非医疗目的而反复使用产生依赖性的药品 |
分析 A、阿司匹林是乙酰水杨酸的俗称;
B、治疗水杨酸中毒应注射碳酸氢钠溶液;
C、青霉素是一种弱酸性物质;
D、毒品能使人成瘾.
解答 解:A、阿司匹林是乙酰水杨酸的俗称,是常用的解热镇痛药,故A错误;
B、治疗水杨酸中毒应注射碳酸氢钠溶液,而非碳酸钠溶液,故B错误;
C、青霉素是一种弱酸性物质,是常用的抗生素,故C错误;
D、毒品能使人成瘾,是指非医疗目的而反复使用产生依赖性的药品,故D正确.
故选D.
点评 本题考查了生活中常用药品的作用和副作用,难度不大,应注意的是水杨酸中毒应注射碳酸氢钠溶液.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案
相关题目
4.下列除杂试剂选择正确的是( )
| 物质(杂质) | 除杂试剂 | |
| A | NaHCO3(Na2CO3) | 稀盐酸 |
| B | CO2(HCl) | 饱和碳酸钠溶液 |
| C | NH3(H2O) | 浓硫酸 |
| D | Fe3+(Fe2+) | 过氧化氢溶液 |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法正确的是( )
| A. | 氢化物的沸点:H2O>PH3>NH3 | |
| B. | 第三周期元素(除惰性元素),随着原子序数的递增,元素的最高化合价逐渐升高 | |
| C. | 同主族元素从上到下,非金属性逐渐增强,金属性逐减弱 | |
| D. | P的非金属性强于Si,H2SiO3的酸性强于H3PO4 |
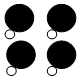
9.如图为某反应的部分微观示意图,其中不同球代表不同元素的原子.下列说法正确的是( )
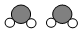 +
+ →
→ +4X.
+4X.
 +
+ →
→ +4X.
+4X.| A. | 该反应属于置换反应 | B. | 参加反应的两种分子个数比为1:1 | ||
| C. | 1个X分子中含有3个原子 | D. | 1个X分子中含有3种不同的原子 |
3.在浓度均为4mol•L-1的盐酸和硫酸各100mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2:3,则加入铁粉的质量是( )
| A. | 22.4 g | B. | 16.8 g | C. | 11.2 g | D. | 8.4 g |