题目内容
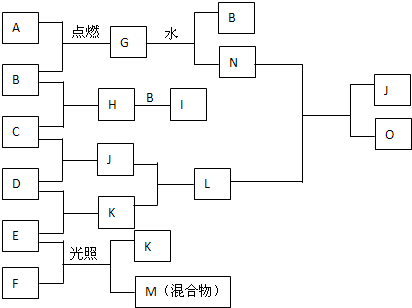
已知A是单质,E的水溶液显强酸性.A、B、C、D、E 是含有一种相同元素的五种物质,在一定条件下可发生如图所示的转化.则A是:( )


| A、Cl2或C | B、N2或S | C、S或C | D、C或N2 |
分析:A是单质,A能和氢气反应,则A是非金属单质,A能被氧气氧化生成C,C能被氧化生成D,则A在氧化物中是变价元素,E有酸性和强氧化性,则E是非金属性较强的元素,据此分析解答.
解答:解:A是单质,A能和氢气反应,则A是非金属单质,A能被氧气氧化生成C,C能被氧化生成D,则A在氧化物中是变价元素,E有酸性和强氧化性,则E是非金属性较强的元素,
A.氯气和氢气反应生成氯化氢,氯化氢和氧气不反应,碳和氧气反应生成一氧化碳,一氧化碳和氧气反应生成二氧化碳,二氧化碳和水反应生成碳酸,但碳酸是弱酸,故A错误;
B.氮气和氢气反应生成氨气,氨气和氧气反应生成一氧化氮和水,氮气和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,硝酸是强酸且是强氧化性酸;硫和氢气反应生成硫化氢,硫化氢和氧气反应生成二氧化硫,硫和氧气反应生成二氧化硫,二氧化硫和氧气反应生成三氧化硫,三氧化硫和水反应生成硫酸,硫酸是强酸且是强氧化性酸,故B正确;
C.硫和氢气反应生成硫化氢,硫化氢和氧气反应生成二氧化硫,硫和氧气反应生成二氧化硫,二氧化硫和氧气反应生成三氧化硫,三氧化硫和水反应生成硫酸,硫酸是强酸且是强氧化性酸,碳和氧气反应生成一氧化碳,一氧化碳和氧气反应生成二氧化碳,二氧化碳和水反应生成碳酸,但碳酸是弱酸,故C错误;
D.氮气和氢气反应生成氨气,氨气和氧气反应生成一氧化氮,氮气和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,硝酸是强酸且是强氧化性酸;碳和氧气反应生成一氧化碳,一氧化碳和氧气反应生成二氧化碳,二氧化碳和水反应生成碳酸,但碳酸是弱酸,故D错误;
故选B.
A.氯气和氢气反应生成氯化氢,氯化氢和氧气不反应,碳和氧气反应生成一氧化碳,一氧化碳和氧气反应生成二氧化碳,二氧化碳和水反应生成碳酸,但碳酸是弱酸,故A错误;
B.氮气和氢气反应生成氨气,氨气和氧气反应生成一氧化氮和水,氮气和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,硝酸是强酸且是强氧化性酸;硫和氢气反应生成硫化氢,硫化氢和氧气反应生成二氧化硫,硫和氧气反应生成二氧化硫,二氧化硫和氧气反应生成三氧化硫,三氧化硫和水反应生成硫酸,硫酸是强酸且是强氧化性酸,故B正确;
C.硫和氢气反应生成硫化氢,硫化氢和氧气反应生成二氧化硫,硫和氧气反应生成二氧化硫,二氧化硫和氧气反应生成三氧化硫,三氧化硫和水反应生成硫酸,硫酸是强酸且是强氧化性酸,碳和氧气反应生成一氧化碳,一氧化碳和氧气反应生成二氧化碳,二氧化碳和水反应生成碳酸,但碳酸是弱酸,故C错误;
D.氮气和氢气反应生成氨气,氨气和氧气反应生成一氧化氮,氮气和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,硝酸是强酸且是强氧化性酸;碳和氧气反应生成一氧化碳,一氧化碳和氧气反应生成二氧化碳,二氧化碳和水反应生成碳酸,但碳酸是弱酸,故D错误;
故选B.
点评:本题属于一道推断题,明确物质之间的反应及其性质是寻找解题的突破口的关键,题目难度中等.

练习册系列答案
相关题目