题目内容
下列反应属于氧化还原反应的是( )
| A、NH3+HCl=NH4Cl | ||||
B、CuO+H2
| ||||
C、CaCO3
| ||||
| D、H2SO4+2NaOH=Na2SO4+2H2O |
考点:氧化还原反应
专题:氧化还原反应专题
分析:含元素化合价变化的反应为氧化还原反应,以此来解答.
解答:
解:A.反应前后各元素的化合价不变,不属于氧化还原反应,故A不选;
B.Cu元素的化合价降低,H元素的化合价升高,属于氧化还原反应,故B选;
C.反应前后各元素的化合价不变,不属于氧化还原反应,故C不选;
D.反应前后各元素的化合价不变,不属于氧化还原反应,故D不选;
故选B.
B.Cu元素的化合价降低,H元素的化合价升高,属于氧化还原反应,故B选;
C.反应前后各元素的化合价不变,不属于氧化还原反应,故C不选;
D.反应前后各元素的化合价不变,不属于氧化还原反应,故D不选;
故选B.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意化合价的原则及常见元素的化合价,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用如图装置不能达到实验目的是( )


| A、用甲图装置比较NaHCO3和Na2CO3的热稳定性 |
| B、用乙图装置制备Fe(OH)2 |
| C、用丙图装置制备并收集少量NO2气体 |
| D、用丁图装置制取少量金属锰 |
关于下列四个说法正确的是( )
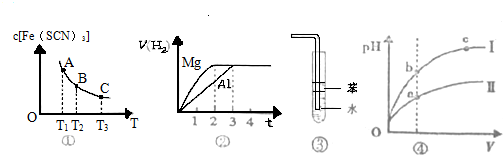

| A、已知图①是体系Fe3++3SCN-?Fe(SCB)3中c[Fe(SCN)3]与温度T的平衡图象,则A点与B点相比,A点的Fe3+浓度大 |
| B、图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V(H2) 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 |
| C、图③可用于吸收HCl气体,并防倒吸 |
| D、图④是某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线,II为醋酸稀释时pH的变化曲线 |

 图中方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型.请分别填出:
图中方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型.请分别填出: