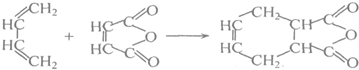
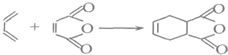
题目内容
下列叙述正确的是( )
| A、在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、0.2 mol?L-1的盐酸,与等体积水混合后pH=1 |
| D、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)>c(Na+) |
考点:弱电解质在水溶液中的电离平衡,离子浓度大小的比较
专题:
分析:A、根据弱电解质的电离平衡来分析稀释后的pH;
B、酚酞的变色范围是pH:8.0~10.0;
C、据pH的计算方法求算;
D、据电荷守恒判断.
B、酚酞的变色范围是pH:8.0~10.0;
C、据pH的计算方法求算;
D、据电荷守恒判断.
解答:
解:A、因醋酸是弱电解质,稀释时促进电离,但氢离子的浓度减小,则pH变大,即b>a,故A错误;
B、酚酞的变色范围是pH=8.0~10.0(无色→红色),在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,pH不一定小于7,可能在7~8之间,故B错误;
C、0.2mol/L的盐酸中氢离子浓度为0.2mol/L,与水等体积混合,氢离子浓度变为0.1mol/L,pH=1,故C正确;
D、pH=5.6的CH3COOH与CH3COONa混合溶液中,氢离子浓度大于氢氧根离子,据电荷守恒,c(CH3COO-)>c(Na+),故D正确;
故选CD.
B、酚酞的变色范围是pH=8.0~10.0(无色→红色),在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,pH不一定小于7,可能在7~8之间,故B错误;
C、0.2mol/L的盐酸中氢离子浓度为0.2mol/L,与水等体积混合,氢离子浓度变为0.1mol/L,pH=1,故C正确;
D、pH=5.6的CH3COOH与CH3COONa混合溶液中,氢离子浓度大于氢氧根离子,据电荷守恒,c(CH3COO-)>c(Na+),故D正确;
故选CD.
点评:本题考查弱电解质的电离及pH的计算、电荷守恒等,题目难度中等.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
A、B、C三个电解槽,A槽是CuCl2水溶液,纯铜片做阴极,B、C都是AgNO3水溶液,纯银丝做阴极,先将A、B槽并联,再与C槽串联进行电解,当B槽中银丝质量增加0.108g,C槽银丝质量增加0.216g时,A槽中铜片质量增加了( )
| A、0.216g |
| B、0.108g |
| C、0.064g |
| D、0.032g |
在①甲烷、②乙烯、③苯、④乙醇四种分子中,分子内所有原子均在同一平面的是( )
| A、①② | B、②③ | C、③④ | D、②④ |
下列说法正确的是( )
| A、硅是良好的半导体材料,能与盐酸或氢氧化钠溶液反应 |
| B、二氧化硅不导电,能与盐酸或氢氧化钠溶液反应 |
| C、硅酸具有多孔性结构,可用作吸附剂或催化剂的载体 |
| D、二氧化硅是酸性氧化物,能与氢氟酸反应,也能与氢氧化钠溶液反应 |
在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用υ(A)、υ(B)、υ(C)(mol?L-1?s-1)表示,且υ(A)、υ(B)、υ(C)之间有如下所示的关系:υ(B)=3υ(A); 3υ(C)=2υ(B).则此反应可表示为( )
| A、2A+3B?2C |
| B、A+3B?2C |
| C、3A+B?2C |
| D、A+B?C |
下列关于二氧化硅的说法中,正确的是( )
| A、因高温时SiO2与Na2CO3反应放出CO2,所以硅酸的酸性比碳酸强 |
| B、二氧化硅分子由一个硅原子和两个氧原子组成 |
| C、不能用二氧化硅跟水直接反应制取硅酸 |
| D、二氧化硅既能与氢氟酸反应,又能与烧碱反应,所以它是两性氧化物 |
将5.85g NaCl固体和19g MgCl2固体溶于水中得到100mL溶液,此溶液中Cl-的物质的量浓度为( )
| A、2mol/L |
| B、3mol/L |
| C、4mol/L |
| D、5mol/L |