题目内容
某盐溶液的焰色反应呈黄色.向此溶液中滴入少量盐酸,产生白色沉淀,继续加入过量盐酸时,白色沉淀消失.再加入过量氨水,又生成白色沉淀.由此可知,该盐的化学式为 .
考点:钠的重要化合物
专题:元素及其化合物
分析:根据焰色反应呈黄色,说明含有钠元素;向此溶液中滴入少量盐酸,产生白色沉淀,继续加入过量盐酸时,白色沉淀消失,则说明生成的沉淀溶于盐酸,则含偏铝酸根离子,再加入过量氨水,又生成白色沉淀,据此分析;
解答:
解:根据焰色反应呈黄色,说明含有钠元素;向此溶液中滴入少量盐酸,产生白色沉淀,继续加入过量盐酸时,白色沉淀消失,则说明生成的沉淀溶于盐酸,则含偏铝酸根离子,再加入过量氨水,则铝离子与氨水反应又生成白色沉淀,所以该盐的化学式为NaAlO2,
故答案为:NaAlO2.
故答案为:NaAlO2.
点评:主要考查了偏铝酸盐的性质,着重掌握氢氧化铝的两性,难度不大;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、光纤有广泛的用途.制造光纤的主要材料是单质硅 |
| B、氢氧化钠、碳酸氢钠、氢氧化铝都可用作抗酸药 |
| C、甲醛的水溶液具有杀菌、防腐的作用,可用于海产品保鲜 |
| D、水垢中含有的硫酸钙可用饱和碳酸钠溶液处理,使之转化为碳酸钙 |
下列叙述正确的是( )
| A、在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、0.2 mol?L-1的盐酸,与等体积水混合后pH=1 |
| D、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)>c(Na+) |
下列各组中的离子,能在溶液中大量共存的是( )
| A、H+、Na+、CO32- |
| B、H+、Ag+、NO3- |
| C、H+、OH-、SO42- |
| D、Cl-、Ba2+、SO42- |
下列叙述正确的是( )
| A、摩尔是指物质所含的粒子个数,它是物质的数量单位 |
| B、任何物质的摩尔质量等于它的相对原子质量或相对分子质量 |
| C、0.012kgC原子中的原子数为1mol |
| D、在标准状况下,CH4与CO2混合物22.4L,所含有的分子数为NA |
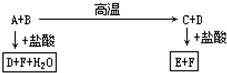 化合物A、D、F是中学化学中最常见的物质,化合物B、C、E中含有两种相同的元素,这些化合物之间存在如下关系:
化合物A、D、F是中学化学中最常见的物质,化合物B、C、E中含有两种相同的元素,这些化合物之间存在如下关系:
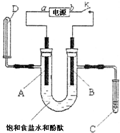 某实验兴趣小组用碳棒和铁棒,利用右图所示装置进行电解食盐水并检验其生成产物的实验,当图中开关k闭合片刻后,试填空:
某实验兴趣小组用碳棒和铁棒,利用右图所示装置进行电解食盐水并检验其生成产物的实验,当图中开关k闭合片刻后,试填空: