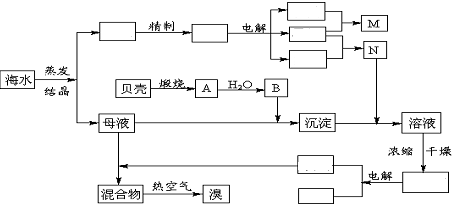
题目内容
8.在用RCl2固体配制溶液时,为了得到澄清溶液并防止变质,常向溶液中加入少量R的单质和盐酸.已知R2+有5个电子层,其最外层有2个电子,则下列推断正确的是( )| A. | R为ⅡA族元素 | B. | R(OH)4是强碱 | ||
| C. | RCl2有还原性,容易被氧化 | D. | R2+的硝酸盐溶液呈中性 |
分析 已知R2+有5个电子层,其最外层有2个电子,则R原子最外层电子排布式为5s25p2,主族元素最外层电子数与其族序数相等,所以R属于第IVA族,为Sn元素,当把固体SnCl2溶于水配制成溶液时,需加入少量的固体Sn单质和盐酸,说明+2价Sn不稳定易被氧化,且该盐是强酸弱碱盐易水解,加入盐酸能抑制其水解.
解答 解:已知R2+有5个电子层,其最外层有2个电子,则R原子最外层电子排布式为5s25p2,主族元素最外层电子数与其族序数相等,所以R属于第IVA族,为Sn元素,当把固体SnCl2溶于水配制成溶液时,需加入少量的固体Sn单质和盐酸,说明+2价Sn不稳定易被氧化,且该盐是强酸弱碱盐易水解,
A.由分析可知,R属于第IVA族,故A错误;
B.当把固体SnCl2溶于水配制成溶液时,需加入少量的盐酸,说明SnCl2是强酸弱碱盐,易水解,所以Sn(OH)2是弱碱,R(OH)4也是弱碱,故B错误;
C.当把固体SnCl2溶于水配制成溶液时,需加入少量的固体Sn单质,说明+2价Sn不稳定易被氧化,故C正确;
D.SnCl2是强酸弱碱盐,易水解而使其溶液呈酸性,故D错误;
故选C.
点评 本题考查了元素的推断及元素周期律等知识点,先根据离子最外层电子排布式确定元素,再结合元素周期律、盐类水解、氧化还原反应等知识点来分析解答,难度中等.

练习册系列答案
相关题目
18. 最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
 最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入空气 | |
| B. | 电解过程中,生成0.1 mol乙酸的同时,有0.2 mol的乙醇生成 | |
| C. | 阳极反应CH3CHO-2e-+OH-═CH3COOH+H+ | |
| D. | 电解过程中两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2 |
16.实验室中,下列除去括号内杂质的有关操作正确的是( )
| A. | 苯(硝基苯):加少量蒸馏水振荡,静置分层后分液 | |
| B. | 乙醇(水):加新制的生石灰,蒸馏 | |
| C. | CO2(HCl、水蒸气):通过盛有碱石灰的干燥管 | |
| D. | 环己烷(苯):通入氢气发生加成反应 |
13.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲是由其中的三种元素组成的化合物,0.lmol•L-1甲溶液的pH为13(25℃),Y元素最低负化合价的绝对值与其原子最外层电子数相等,下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第IVA族 | |
| C. | 与氢气化合时,Z比Y容易 | |
| D. | 甲中只含有离子键 |
20.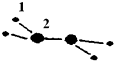 (1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图:
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图: .
.
(2)已知1.0mol•L-1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低.溶液pH降低的原因是HSO3-+Cl2+H2O=3H++SO42-+2Cl-(用离子方程式表示).
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表.则该反应的热化学方程式为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2O(l)?NH3(g)+$\frac{3}{4}$O2(g)△H=+382.5kJ/mol(或2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol).
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq)+Mg(OH)2(s)?Mg2+(aq)+2NH3•H2O(aq)
写出上述反应的平衡常数表达式K=$\frac{c(M{g}^{2+})•{c}^{2}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(N{{H}_{4}}^{+})}$
某研究性学习小组为探究Mg2+与NH3•H2O反应形成沉淀的情况,设计如下两组实验
请分析实验①、②产生不同现象的原因:从平衡表达式可以看出,当c(NH3•H2O)、c(Mg2+)改变相同的程度,c2(NH3•H2O)对沉淀生成的影响更大[或①中c(Mg2+)•c2(OH-)≥Ksp[Mg(OH)2],而②中c(Mg2+)•c2(OH-)<Ksp[Mg(OH)2].
(5)在室温下,化学反应I-(aq)+ClO-(aq)=IO-(aq)+Cl-(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
已知表中初始反应速率与有关离子浓度关系可以表示为v=k[I-]1[ClO-]b[OH-]c(温度一定时,k为常数).
①设计实验2和实验4的目的是探究ClO-对反应速率的影响;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH=13,反应的初始速率v=7.2×10-4.
 (1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图:
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图: .
.(2)已知1.0mol•L-1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低.溶液pH降低的原因是HSO3-+Cl2+H2O=3H++SO42-+2Cl-(用离子方程式表示).
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表.则该反应的热化学方程式为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2O(l)?NH3(g)+$\frac{3}{4}$O2(g)△H=+382.5kJ/mol(或2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol).
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
2NH4+(aq)+Mg(OH)2(s)?Mg2+(aq)+2NH3•H2O(aq)
写出上述反应的平衡常数表达式K=$\frac{c(M{g}^{2+})•{c}^{2}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(N{{H}_{4}}^{+})}$
某研究性学习小组为探究Mg2+与NH3•H2O反应形成沉淀的情况,设计如下两组实验
| 实验① | 等体积1mol/L氨水和0.1mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1mol/L氨水和1mol/L MgCl2溶液混合 | 无现象 |
(5)在室温下,化学反应I-(aq)+ClO-(aq)=IO-(aq)+Cl-(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
| 实验编号 | I-的初始浓度 (mol•L-1) | ClO-的初始浓度 (mol•L-1) | OH-的初始浓度 (mol•L-1) | 初始速率v (mol•L-1•s-1) |
| 1 | 2×10-3 | 1.5×10-3 | 1.00 | 1.8×10-4 |
| 2 | a | 1.5×10-3 | 1.00 | 3.6×10-4 |
| 3 | 2×10-3 | 3×10-3 | 2.00 | 1.8×10-4 |
| 4 | 4×10-3 | 3×10-3 | 1.00 | 7.2×10-4 |
①设计实验2和实验4的目的是探究ClO-对反应速率的影响;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH=13,反应的初始速率v=7.2×10-4.
17.我市某地的煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:

已知:
请回答下列问题:
(1)“酸浸”后得到的残渣中主要含有的物质是SiO2.物质X的化学式为CO2.
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)盐酸的浓度、反应温度.
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节溶液pH至3.2,过滤洗涤除去Fe(OH)3后,再继续加入CaCO3调节溶液pH到5.4,过滤洗涤得到Al(OH)3.
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3.
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH).该电池反应的化学方程式是Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3.
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t煤矸石中铝元素的回收率为96.9%.

已知:
| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.1 | 3.2 |
| Al3+ | 4.1 | 5.4 |
(1)“酸浸”后得到的残渣中主要含有的物质是SiO2.物质X的化学式为CO2.
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)盐酸的浓度、反应温度.
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节溶液pH至3.2,过滤洗涤除去Fe(OH)3后,再继续加入CaCO3调节溶液pH到5.4,过滤洗涤得到Al(OH)3.
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3.
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH).该电池反应的化学方程式是Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3.
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t煤矸石中铝元素的回收率为96.9%.