题目内容
17.我市某地的煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
已知:
| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.1 | 3.2 |
| Al3+ | 4.1 | 5.4 |
(1)“酸浸”后得到的残渣中主要含有的物质是SiO2.物质X的化学式为CO2.
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)盐酸的浓度、反应温度.
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节溶液pH至3.2,过滤洗涤除去Fe(OH)3后,再继续加入CaCO3调节溶液pH到5.4,过滤洗涤得到Al(OH)3.
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3.
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH).该电池反应的化学方程式是Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3.
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t煤矸石中铝元素的回收率为96.9%.
分析 含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物用盐酸酸浸发生的反应为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;则过滤的溶液为氯化铁和氯化铝的溶液,加碳酸钙消耗溶液中的氢离子使三价铁离子、三价铝离子都水解生成氢氧化铁、氢氧化铝的沉淀,所以再加入氢氧化钠,只要氢氧化铝溶解反应为:Al(OH)3+OH-═AlO2-+2H2O,所得溶液为偏铝酸钠溶液再通入二氧化碳进一步反应又生成氢氧化铝;
(1)能和酸反应的物质有氧化铝和氧化铁,二氧化硅为残渣;X是碳酸钙和水解中的氢离子反应生成二氧化碳;
(2)酸浸”时铝浸出率的影响因素可能是酸的浓度、温度、反应物的接触面积、反应时间等都影响反应速率;
(3)由于Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,而Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4.所以为了得到纯净的Al(OH)3,首先加入CaCO3调节pH到3.2,得到Fe(OH)3,将其过滤除去后;
(4)Al(OH)3的分解反应是吸热反应且生成的氧化铝的熔点高;
(5)根据原电池原理,Al、MnO2和H2O发生氧化还原反应生成MnO(OH)和Al(OH)3;
(6)煤矸石中铝元素的回收率=$\frac{产品中的铝元素质量}{煤矸石中铝元素的质量}$×100%.
解答 解:含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物用盐酸酸浸发生的反应为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;则过滤的溶液为氯化铁和氯化铝的溶液,加碳酸钙消耗溶液中的氢离子使三价铁离子、三价铝离子都水解生成氢氧化铁、氢氧化铝的沉淀,所以再加入氢氧化钠,只要氢氧化铝溶解反应为:Al(OH)3+OH-═AlO2-+2H2O,所得溶液为偏铝酸钠溶液再通入二氧化碳进一步反应又生成氢氧化铝;
(1)能和酸反应的物质有氧化铝和氧化铁,二氧化硅不与酸反应,为残渣;X是碳酸钙和水解中的氢离子反应生成二氧化碳,
故答案为:SiO2;CO2;
(2)酸的浓度、温度、反应物接触面积、是否充分搅拌、反应时间等都影响反应速率,
故答案为:酸的浓度;温度;
(3)Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4,要使铁离子完全沉淀而铝离子不沉淀,则溶液的PH应该为3.2,过滤氢氧化铝沉淀时调节溶液pH为5.4,以使氢氧化铝完全沉淀,
故答案为:加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3;
(4)Al(OH)3的分解反应是吸热反应且生成的氧化铝的熔点高,所以Al(OH)3可添加到塑料中作阻燃剂,
故答案为:Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3;
(5)根据原电池原理,Al、MnO2和H2O发生氧化还原反应生成MnO(OH)和Al(OH)3,方程式为Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3;
故答案为:Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3;
(6)煤矸石中铝元素的回收率=$\frac{产品中的铝元素质量}{煤矸石中铝元素的质量}$×100%=$\frac{39t×95%×\frac{27}{78}}{100t×25%×\frac{54}{102}}$×100%=96.9%;
故答案为:96.9%.
点评 本题以工艺流程为载体考查了溶解平衡原理、物质间的反应、除杂等知识点,这种题型是高考常考题型,综合性较强,涉及知识面较广,用教材基础知识采用知识迁移的方法分析解答,难度中等.

 金钥匙试卷系列答案
金钥匙试卷系列答案| A. | R为ⅡA族元素 | B. | R(OH)4是强碱 | ||
| C. | RCl2有还原性,容易被氧化 | D. | R2+的硝酸盐溶液呈中性 |
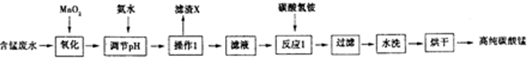
(1)加入MnO2的作用是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O(用离子方程式表示).
(2)下表列出了几种离子生成氢氧化物沉淀时的pH
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Fe3+ | 1.5 | 3.1 |
| Fe2+ | 6.5 | 9.7 |
| Al3+ | 3.3 | 5.2 |
| Mn2+ | 7.8 | 10.4 |
(3)滤渣X的主要成分为Fe(OH)3、Al(OH)3,滤液中的溶质为MnSO4、(NH4)2SO4.
(4)已知反应1中会产生一种气体,则该反应的化学方程式为2NH4HCO3+MnSO4=MnCO3+(NH4)2SO4+CO2↑+H2O.
(5)判断水洗步骤中沉淀已洗净的方法是取最后一次的洗涤液于试管中,加入BaCl2溶液和稀硝酸,若无白色沉淀,说明已洗净.
(6)制得的碳酸锰可用于工业上电解法冶炼金属锰.该生产中需先将碳酸锰溶于强酸,配成电解液,写出该反应的离子方程式MnCO3+2H+=Mn2++CO2↑+H2O.
| A. | 总物质的量一定时,任意比混合,生成H2O的物质的量不同 | |
| B. | 总质量一定时,任意比混合,生成H2O的质量相同 | |
| C. | 总物质的量一定时,任意比混合,耗氧量相同 | |
| D. | 总质量一定时,任意比混合,耗氧量相同 |
| A. | 使酚酞变红色的溶液:NH4+、Al3+、NO3-、CO32- | |
| B. | 0.1 mol•L-1NaHCO3溶液:Na+、Ba2+、NO3-、OH- | |
| C. | 滴加KSCN溶液显红色的溶液:NH4+、K+、Cl-、NO3- | |
| D. | 由水电离出的c(H+)=10-12mol•L-1的溶液:Na+、K+、NO3-、ClO- |
| A. | 甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与硝酸在一定条件下反应生成硝基苯;乙烯与溴的四氯化碳溶液反应 | |
| C. | 乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,水层褪色;乙烯与溴水反应 |
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别 | |
| C. | 化合物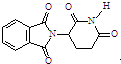 在酸性条件下水解,所得溶液加碱加热后有NH3生成 在酸性条件下水解,所得溶液加碱加热后有NH3生成 | |
| D. | 桶烯(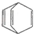 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 |