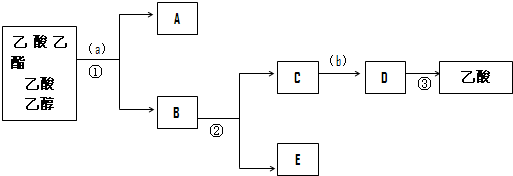
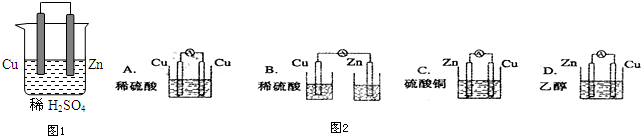
题目内容
18. 最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入空气 | |
| B. | 电解过程中,生成0.1 mol乙酸的同时,有0.2 mol的乙醇生成 | |
| C. | 阳极反应CH3CHO-2e-+OH-═CH3COOH+H+ | |
| D. | 电解过程中两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2 |
分析 A.a为正极,b为负极,负极发生氧化反应,通入甲烷;
B.根据两极得失电子守恒结合电极反应计算;
C.阳极反应为乙醛失电子发生氧化反应;
D.阳极发生4OH--4e-═O2↑+2H2O、CH3CHO-2e-+H2O=CH3COOH+2H+,阴极发生4H++4e-=2H2↑、CH3CHO+2e-+2H2O═CH3CH2OH+2OH-.
解答 解:A.a为正极,b为负极,连接电解池阴极的是原电池负极,负极上燃料失电子发生氧化反应,该燃料电池中燃料是甲烷,所以b电极上投放的是CH4,故A错误;
B.阳极发生4OH--4e-═O2↑+2H2O、CH3CHO-2e-+H2O=CH3COOH+2H+,阴极发生4H++4e-=2H2↑、CH3CHO+2e-+2H2O═CH3CH2OH+2OH-,所以电解过程中,生成0.1 mol乙酸的同时,有0.1mol的乙醇,故B错误;
C.阳极反应为乙醛失电子发生氧化反应,应为CH3CHO-2e-+H2O=CH3COOH+2H+,故C错误;
D.阳极发生4OH--4e-═O2↑+2H2O、CH3CHO-2e-+H2O=CH3COOH+2H+,阴极发生4H++4e-=2H2↑、CH3CHO+2e-+2H2O═CH3CH2OH+2OH-,则两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2,故D正确.
故选D.
点评 本题考查了原电池和电解池的原理,侧重于学生的分析能力的考查,为高频考点,注意把握反应的原理和电极方程式的书写,为解答该题的关键,难度中等.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | 第二周期元素的第一电离能随原子序数递增依次增大 | |
| B. | CH2=CH2分子中共有四个σ键和一个π键 | |
| C. | CO2、SO2都是直线形的非极性分子 | |
| D. | 电负性:S>P |
13.在密闭容器中进行如下可逆反应:X2(g)+Y2(g)?2XY(g),已知X2、Y2、XY三者起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下反应处于平衡,此时容器中不可能的情况是( )
| A. | XY为0.3mol/L | B. | Y2为0.35mol/L | ||
| C. | X2为0.2mol/L | D. | X2、Y2、XY总浓度为0.6mol/L |
10.“类推”是一种在化学学习中常用的方法,下列类推结论中正确的是( )
| A. | ⅣA族元素氢化物熔点顺序:GeH4>SiH4>CH4;则ⅥA族元素氢化物熔点顺序也应为:H2Se>H2S>H2O | |
| B. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是HCl>H2S>PH3 | |
| C. | 钠为银白色推知碱金属都是银白色 | |
| D. | BaCl2溶液中通入SO2无沉淀产生,则Ba(NO3)2溶液中通入SO2也无沉淀产生 |
7.近期我国合成多种元素的新同位素,其中一种是${\;}_{72}^{185}$Hf(铪),它的中子数和电子数之差是( )
| A. | 41 | B. | 72 | C. | 113 | D. | 185 |
8.在用RCl2固体配制溶液时,为了得到澄清溶液并防止变质,常向溶液中加入少量R的单质和盐酸.已知R2+有5个电子层,其最外层有2个电子,则下列推断正确的是( )
| A. | R为ⅡA族元素 | B. | R(OH)4是强碱 | ||
| C. | RCl2有还原性,容易被氧化 | D. | R2+的硝酸盐溶液呈中性 |
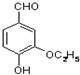 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.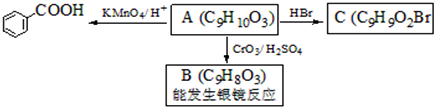
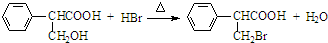 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
.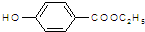 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用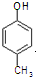 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).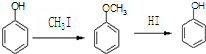

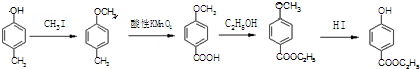
 .
.